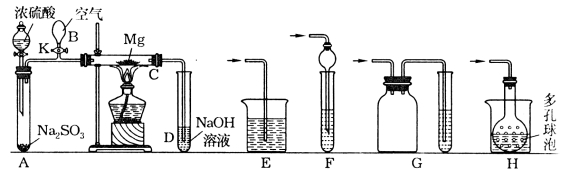
题目内容
【题目】(1)多硫化钠Na2Sx(x≥2)在NaOH溶液中可被NaClO氧化成Na2SO4,而NaClO被还原为NaCl,请写出该反应的化学方程式 。
(2)某一反应体系中有反应物和生成物共6种:HC1、H2SO4、SnC12、SnC14、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失。
①该反应的氧化剂是 。
②在该反应中,发生氧化反应的过程是 → 。
③写出该反应的化学方程式,并标出电子转移的方向和数目: 。
④SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为 。
【答案】(1)(3X+1)NaClO+Na2Sx+(2X-2)NaOH=(3X+1)NaCl+XNa2SO4+(X-1)H2O
(2)①Fe2(SO4)3
②SnC12 SnC14
③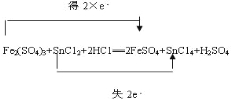
④1:2
【解析】
试题分析:(1)Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,S元素的化合价由-![]() 价变为+6价,NaClO被还原成NaCl,Cl元素的化合价由+1价变为-1价,根据得失电子守恒得,Na2Sx与次氯酸钠的物质的量比是2:(6X+2)即1:(3X+1);该反应的化学方程式(3X+1)NaClO+Na2Sx+(2X-2)NaOH= (3X+1)NaCl+XNa2SO4+(X-1)H2O;(2)①“反应后的溶液中滴加KSCN溶液不显红色”说明Fe2(SO4)3不存在,被还原了;可知Fe2(SO4)3作反应物且是氧化剂,其还原产物为FeSO4.② “有还原必有氧化”,那么只能是SnCl2被氧化成SnCl4。在该反应中,发生氧化反应的过程SnC12→SnC14;
价变为+6价,NaClO被还原成NaCl,Cl元素的化合价由+1价变为-1价,根据得失电子守恒得,Na2Sx与次氯酸钠的物质的量比是2:(6X+2)即1:(3X+1);该反应的化学方程式(3X+1)NaClO+Na2Sx+(2X-2)NaOH= (3X+1)NaCl+XNa2SO4+(X-1)H2O;(2)①“反应后的溶液中滴加KSCN溶液不显红色”说明Fe2(SO4)3不存在,被还原了;可知Fe2(SO4)3作反应物且是氧化剂,其还原产物为FeSO4.② “有还原必有氧化”,那么只能是SnCl2被氧化成SnCl4。在该反应中,发生氧化反应的过程SnC12→SnC14;
据此可给出反应的总方程式:Fe2(SO4)3+SnCl2+2HCl=2FeSO4+SnCl4+H2SO4;
电子转移的方向和数目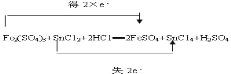
④SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),SnC12中Sn化合价升高2,是还原剂,HgC12中Hg元素化合价降低1是氧化剂,该反应中还原剂与氧化剂的物质的量之比为1:2。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案