题目内容
【题目】在一定条件下,N2O氧化NO生成N2和NO2的能量变化如图所示,下列说法不正确的是

A. 反应生成1molN2时转移4mole-
B. 反应物的总能量大于生成物的总能量
C. N2O(g)+NO(g)═N2(g)+NO2(g); △H=-139kJ/mol
D. 反应中断裂化学键吸收的能量小于形成化学键释放的能量
【答案】A
【解析】
本题考查化学反应与能量变化、氧化还原反应。
A. 发生的反应为N2O+NO═N2+NO2,N2O发生还原反应生成1mol N2时转移2mol e-,A项错误;
B. 由图象可知,反应物的总能量大于生成物的总能量,B项正确;
C. 该反应的焓△H=209kJ/mol-348kJ/mol=-139 kJ/mol,C项正确;
D.该反应是放热反应,所以反应中断裂化学键吸收的总能量小于形成化学键释放的总能量,D项正确。答案选A项。

 名校课堂系列答案
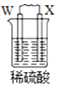
名校课堂系列答案【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移