题目内容
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
Ⅰ.(1)铁元素在周期表中的位置为___________。
(2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是___________ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是 ___________ 。
(2)煅烧FeCO3生成产品Ⅰ的化学方程式为___________。
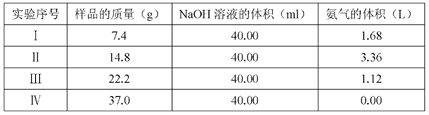
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为 ___________ 。

(4)写出步骤Ⅳ反应的离子方程式:___________。
【答案】第四周期第Ⅷ族cFe3+、Fe2+(或铁离子、亚铁离子)4FeCO3+O2═2Fe2O3+4CO2K2SO4Fe2++2HCO3-![]() ═FeCO3↓+CO2+H2O
═FeCO3↓+CO2+H2O
【解析】
Ⅰ.(1)根据铁原子结构推断铁元素在周期表中位置。
(2)四氧化三铁具有铁磁性。
Ⅱ.(1)由流程可知,酸浸时使用的酸是稀硫酸,二氧化硅不与稀硫酸反应,其它的三种氧化物可与稀硫酸反应。
(2)在有空气存在的条件下,煅烧碳酸亚铁会产生铁红、二氧化碳。
(3)硫酸钾的溶解度小,易析出。
(4)亚铁离子与碳酸氢铵反应生成碳酸铁和二氧化碳。
Ⅰ.(1)铁元素的核电荷数为26,原子结构示意图为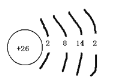 ,铁元素在周期表中的位置为第四周期第Ⅷ族;正确答案:第四周期第Ⅷ族。
,铁元素在周期表中的位置为第四周期第Ⅷ族;正确答案:第四周期第Ⅷ族。
(2)四氧化三铁具有铁磁性,能够吸引铁,因此指南针中天然磁石主要成分为Fe3O4;正确选项c。
Ⅱ.(1)二氧化硅不与稀硫酸反应,其它的三种氧化物可与酸反应,故存在的离子为Fe3+,Fe2+;正确答案:Fe3+、Fe2+(或铁离子、亚铁离子)。
(2))在有空气存在的条件下,煅烧碳酸亚铁会产生铁红,反应的方程式为FeCO3+O2=2Fe2O3+4CO2;正确答案:4FeCO3+O2═2Fe2O3+4CO2。
(3)从图中信息可知,由于硫酸钾的溶解度小,因此产品II为K2SO4;正确答案:K2SO4。
(4)加入铁粉后,铁粉与铁离子反应,溶液中仅剩亚铁离子,与碳酸氢铵反应的离子方程式为:Fe2++2HCO3-═FeCO3↓+CO2+H2O;正确答案:Fe2++2HCO3-═FeCO3↓+CO2+H2O。

 备战中考寒假系列答案
备战中考寒假系列答案