题目内容
11.H2O2在工业、农业、医药上都有广泛的用途.(1)H2O2是二元弱酸,写出第一步的电离方程式H2O2?H++HO2-,第二步的电离平衡常数表达式Ka2=$\frac{c(H{\;}^{+})c(O{\;}_{2}{\;}^{2-})}{c(HO{\;}_{2}{\;}^{-})}$.
(2)许多物质都可以做H2O2分解的催化剂.一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化).下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是①④.
①I- ②Fe3+ ③Cu2+ ④Fe2+.
分析 (1)H2O2为二元弱酸,分2步电离;平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)根据在反应过程中先被氧化,后被还原的即化合价先升高,后降低,结合元素的化合价来解答;
解答 解:(1)H2O2为二元弱酸,分2步电离,电离方程式分别为:H2O2?H++HO2-,HO2-?H++O22-,第二步的电离平衡常数表达式Ka2=$\frac{c(H{\;}^{+})c(O{\;}_{2}{\;}^{2-})}{c(HO{\;}_{2}{\;}^{-})}$,
故答案为:H2O2?H++HO2-;$\frac{c(H{\;}^{+})c(O{\;}_{2}{\;}^{2-})}{c(HO{\;}_{2}{\;}^{-})}$;
(2)①I-的化合价可先升高到0价,再降低到-1价,符合题意;
②Fe3+的化合价只能先降低,然后再升高,不符合题意;
③Cu2+的化合价只能先降低,然后再升高,不符合题意,
④Fe2+的化合价可先升高到+3价,再降低到+2价,符合题意,
故选:①④;
点评 本题是一道综合知识题目,涉及实验操作,电离方程式式、平衡常数、氧化还原反应,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
1.下列化学式表示的物质一定为纯净物的是( )
| A. | C3H8 | B. | C4H10 | C. | C12H22O11 | D. | (C6H10O5)n |
2.下列过程中所发生的化学变化属于取代反应的是( )
| A. | 乙烯通入溴水中 | |
| B. | 光照射甲烷与氯气的混合气体 | |
| C. | 在镍作催化剂的条件下,苯与氢气反应 | |
| D. | 乙醇与酸性重铬酸钾溶液反应 |
19.将NO2、NH3、O2的混和气体22.4升通过稀硫酸后,溶液的质量增加23.6克,气体体积缩小为4.48升(气体体积均在标准状况下测定),剩余气体能使带余烬的木条复燃,则混和气体的平均相对分子质量为( )
| A. | 28 | B. | 30 | C. | 32 | D. | 34 |
6.对于Na+、Mg2+、Al3+三种离子,下列说法不正确的是( )
| A. | 核外电子层数相同 | B. | 半径大小顺序Na+<Mg2+<Al3+ | ||
| C. | 核外电子数相同 | D. | 最外层电子数相同 |
16.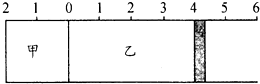 如图所示,甲容器容积不变,乙容器有可移动活塞.甲中充入
如图所示,甲容器容积不变,乙容器有可移动活塞.甲中充入
3mol A和2mol B,乙中充入2mol C和2mol D,发生反应
3A(g)+2B(s)?C(g)+D(g);△H>0.
在相同温度下反应达到平衡,活塞停留在4处.下列有关说法正确的是( )
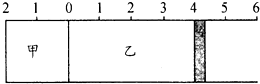 如图所示,甲容器容积不变,乙容器有可移动活塞.甲中充入
如图所示,甲容器容积不变,乙容器有可移动活塞.甲中充入3mol A和2mol B,乙中充入2mol C和2mol D,发生反应
3A(g)+2B(s)?C(g)+D(g);△H>0.
在相同温度下反应达到平衡,活塞停留在4处.下列有关说法正确的是( )
| A. | 平衡后,容器内压强:P甲>P乙 | |
| B. | 平衡后,若向乙中再加入B物质,活塞向右移动 | |
| C. | 平衡后,若将活塞移动至6处,乙中c(A)、c(D)均减小 | |
| D. | 同时升高相同温度,达新平衡时,甲中速率v正(A)等于乙中速率v正(A) |
20.关于有机物HOOC-CH=CH-CH2OH,下列说法不正确的是( )
| A. | 分子式为C4H6O3,每摩尔该物质充分燃烧需消耗4mol O2 | |
| B. | 能发生取代反应、加成反应、氧化反应、中和反应 | |
| C. | 分别与足量钠、氢氧化钠、碳酸钠反应,生成物均为NaOOC-CH=CH-CH2OH | |
| D. | 该物质分子内和分子间都能发生酯化反应 |
1.下列关于元素周期表的说法中,错误的是( )
| A. | 元素原子的最外层电子数等于其所在族的序数 | |
| B. | 元素原子的电子层等于其所在周期的序数 | |
| C. | 同一主族元素的原子最外层电子数相同,化学性质相似 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
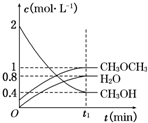 二甲醚(CH3OCH3)是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5J•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.
二甲醚(CH3OCH3)是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5J•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.