题目内容
根据以下三个热化学方程式:
(1)2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH= -Q1kJ·mol-1
(2)2H2S(g)+O2(g)=2S(g)+2H2O(g) ΔH= -Q2kJ·mol-1
(3)2H2S(g)+O2(g)=2S(g)+2H2O(l) ΔH= -Q3kJ·mol-1
判断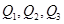 三者关系正确的是
三者关系正确的是
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
B
解析试题分析:硫化氢燃烧得到二氧化硫和水比燃烧得到硫单质和水时氧化程度高释放的热量多。所以Q1>Q2;Q1>Q3,气态水比液态水含有的能量高,所以放热(3) >(2).即Q3>Q2。所以三者关系是:Q1>Q3>Q2。选项为:B。
考点:考查反应热与氧化程度、物质的状态等关系的知识。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案已知下列热化学方程式:
Zn(s)+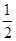 O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
Hg(l)+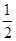 O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是 ( )
| A.-441.8 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-260.4 kJ·mol-1 |
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是( )
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是( )
A.反应过程中能量关系可用下图表示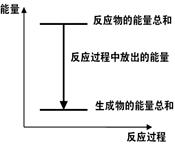 |
| B.ΔH的值与反应方程式的计量系数有关 |
| C.若将该反应设计成原电池则锌为负极 |
| D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq) +OH-(aq)═H2O(l)
△H = -57.3kJ/mol。分别向1L 0.5mol/L的Ba(OH)2的溶液中加入①浓硫酸;② 稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
| A.△H1<△H2=△H3 | B.△H1>△H2>△H3 |
| C.△H1>△H2=△H3 | D.△H1=△H2<△H3 |
在下列各说法中,正确的是( )
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ |
| B.热化学方程式中的化学计量数不能用分数表示 |
| C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能 |
| D.ΔH的大小与热化学方程式的化学计量数无关 |
已知反应 ①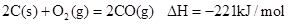
②稀溶液中,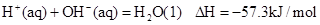 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
下列图示与对应的叙述相符的是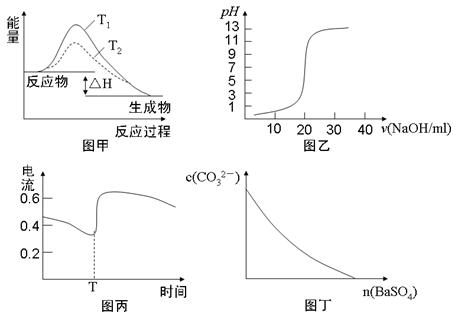
| A.图甲表示T1>T2,SO2与O2反应过程中的能量变化 |
| B.图乙表示0.1000mol·L-1NaOH溶液滴定20.00ml0.1000mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图丙表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 |
| D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
 O2(g)═CO(g) ; △H2
O2(g)═CO(g) ; △H2