题目内容
【题目】I. 反应Fe+H2SO4![]() FeSO4+H2↑ 的能量变化如图所示:
FeSO4+H2↑ 的能量变化如图所示:

(1)该反应为__________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是__________;
A.改铁片为铁粉 B.改稀硫酸为98%的硫酸 C.升高温度
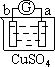
(3)若将上述反应设计成原电池,铜为原电池某一电极材料,则铜为__________(填“正”或“负”)极。铜片上的现象为________________,该极上发生的电极反应为_______________;
II . 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线a,b,c如图所示。根据图中数据填空。

(1)该反应的化学方程式为______________;
(2)反应开始至2min,以气体Z表示的平均反应速率为_____________;
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的_____________倍;
②达平衡时,容器内混合气体的平均相对分子质量和起始投料时相比__________(填“增大”“减小”或“不变”)
【答案】放热 AC 正 有气泡产生 2H++2e-=H2↑ Y+3X![]() 2Z 0.05mol/(L·min) 0.9 增大
2Z 0.05mol/(L·min) 0.9 增大
【解析】
I、(1)根据图中反应物能量大于生成物能量判断;
(2)根据外界条件对速率的影响分析判断;
(3)铜、铁、稀硫酸构成的原电池中,铁易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;
Ⅱ、(1)判断出反应物和生成物,根据物质的量变化之比等于化学计量数之比确定反应的化学方程式;
(2)根据v=![]() 计算反应速率;
计算反应速率;
(3)①在相同温度下,气体的物质的量之比等于压强之比;②根据容器内混合气体的平均相对分子质量在数值上等于摩尔质量来判断。
I、(1)从图象可知,反应物总能量高于生成物总能量,所以该反应为放热反应,故答案为:放热;
(2)A.改铁片为铁粉,增大了反应物的接触面积,反应速率增大,故A正确;B.改稀硫酸为98%的硫酸,常温下,铁在浓硫酸中钝化,不能继续发生反应,故B错误;C.升高温度,反应速率增大,故C正确;故答案为:AC;
(3)铜、铁、稀硫酸构成的原电池中,铁易失电子发生氧化反应,作负极,负极上电极反应式为Fe-2e-=Fe2+;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,故答案为:正;有气泡产生;2H++2e-=H2↑;
Ⅱ、(1)由图象可知,在反应中,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,2min时,X、Y、Z的物质的量不再变化,说明该反应为可逆反应,相同时间内物质的量的变化比值为:n(X)∶n(Y)∶n(Z)=(1.0-0.7)∶(1.0-0.9)∶0.2=3∶1∶2,化学反应中物质的量变化之比等于化学计量数之比,则化学方程式为Y+3X![]() 2Z,故答案为:Y+3X
2Z,故答案为:Y+3X![]() 2Z;
2Z;
(2)反应开始至2min,气体Z的平均反应速率v=![]() =
= =0.05mol/(L·min),故答案为:0.05mol/(L·min);
=0.05mol/(L·min),故答案为:0.05mol/(L·min);
(3)①反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,在相同温度下、相同条件时,气体的物质的量之比等于压强之比,反应达平衡时,此时容器内的压强是起始压强的1.8mol÷2.0mol=0.9倍,故答案为:0.9;
②根据物质的摩尔质量M=![]() ,反应前后气体的质量不变,物质的量减少,所以混合气体的摩尔质量增大,而容器内混合气体的平均相对分子质量在数值上等于摩尔质量,所以平均相对分子质量也增大,故答案为:增大。
,反应前后气体的质量不变,物质的量减少,所以混合气体的摩尔质量增大,而容器内混合气体的平均相对分子质量在数值上等于摩尔质量,所以平均相对分子质量也增大,故答案为:增大。

 新非凡教辅冲刺100分系列答案
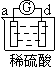
新非凡教辅冲刺100分系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c
【题目】化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)、Cr2![]() 在溶液中与
在溶液中与![]() 存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是______;反应离子方程式_________________________________.
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c/mol· | V/mL | c/mol· | V/mL | V/mL | ||
A | 0.1 | 5 | 0.5 | 5 | 10 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 0.2 mol/LKMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | V | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。