题目内容
实验室配制氯化亚铁溶液时是把氯化亚铁溶解于煮沸过的蒸馏水中,并加入_________________,向氯化亚铁溶液中加入氢氧化钠溶液时能观察到的现象是________________________反应的化学方程式是__________________________、
_______________________________________.
_______________________________________.
铁粉和盐酸;白色沉淀,迅速经灰绿色并转化为红褐色沉淀;
FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O =4Fe(OH)3
FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O =4Fe(OH)3
略

练习册系列答案
相关题目
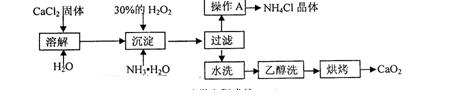
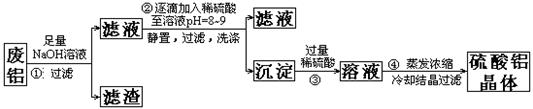
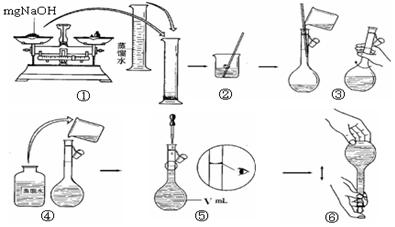
 确程序 。
确程序 。 馏水
馏水