��Ŀ����
����ѧ-ѡ�����ʽṹ�����ʡ�X��Y��Z��Q��E��F����Ԫ���У�Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�Yԭ�Ӻ����L���������K���������Z�ǵؿ��ں�����������������ߵ�Ԫ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�E�ڵڶ���������Ԫ���е縺������Ԫ�أ�
��ش��������⣺
��1��XZ2��YZ2���ӵ�����ṹ�ֱ���______��______����ͬ������������ˮ�е��ܽ�Ƚϴ����______��д����ʽ����������______��
��2��Q��Ԫ�ط�����______�����ĺ�������Ų�ʽΪ______�����γɻ�����ʱ��������ϼ�Ϊ______��
��3���������ʾʽд��E���⻯����Һ�д��ڵ��������______��
��4��F���⻯����һ�ּ������壬F���������γ����ӻ�����FH5�������ʽΪ______���侧�����С�ṹ��Ԫ��ͼ��ʾ��ʵ����CA5������ܶ�Ϊdg/cm3�������ӵ�������NA��ʾ����þ�������������������֮�����̾���Ϊ______

���𰸡����������ݵ��ӵĺ����Ų����ɣ��������ԭ������Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ������Ų�ʽΪ1s22s22p63s23p4����XΪ��Ԫ�أ�Yԭ�Ӻ����L���������K�������������6�����ӣ�YΪ̼Ԫ�أ�Z�ǵؿ��ں�����������������ߵ�Ԫ��Ϊ��Ԫ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�Q�ĺ˵����Ϊ24���Ǹ�Ԫ�أ���Ԫ�����ڱ��ĸ�Ԫ���е縺�������Ƿ�Ԫ�أ���EΪFԪ�أ�XZ2��YZ2����ΪSO2��CO2��SO2��H2O���Ǽ��Է��ӣ����ݡ��������ܡ�ԭ����SO2��H2O�е��ܽ�Ƚϴ���H����O��F��N�γ������
F�����γ����ӻ�����FH5��ӦΪNH4H��Ϊ���ӻ���������к���һ����NH4H���ӡ����辧���ı߳�Ϊacm������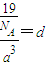 ��a=
��a= ����������������������֮�����̾���Ϊ��������ĵľ��룬Ϊ
����������������������֮�����̾���Ϊ��������ĵľ��룬Ϊ =
= ��
��
����⣺���ݵ��ӵĺ����Ų����ɣ��������ԭ������Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ������Ų�ʽΪ1s22s22p63s23p4����XΪ��Ԫ�أ�Yԭ�Ӻ����L���������K�������������6�����ӣ�YΪ̼Ԫ�أ�Z�ǵؿ��ں�����������������ߵ�Ԫ��Ϊ��Ԫ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�Q�ĺ˵����Ϊ24���Ǹ�Ԫ�أ���Ԫ�����ڱ��ĸ�Ԫ���е縺�������Ƿ�Ԫ�أ���EΪFԪ�أ�
��1��XZ2��YZ2����ΪSO2��CO2��SO2�ļ۲���Ӷ�Ϊ3�����йµ��Ӷ�Ϊ =1��SO2����2���ļ������ӵ����幹��ΪV�Σ�CO2�ļ۲���Ӷ�Ϊ2������2���ļ������ӵ����幹��Ϊֱ���Σ�CO2�ǷǼ��Է��ӣ�SO2��H2O���Ǽ��Է��ӣ����ݡ��������ܡ�ԭ����SO2��H2O�е��ܽ�Ƚϴ�
=1��SO2����2���ļ������ӵ����幹��ΪV�Σ�CO2�ļ۲���Ӷ�Ϊ2������2���ļ������ӵ����幹��Ϊֱ���Σ�CO2�ǷǼ��Է��ӣ�SO2��H2O���Ǽ��Է��ӣ����ݡ��������ܡ�ԭ����SO2��H2O�е��ܽ�Ƚϴ�
�ʴ�Ϊ��V�Σ�ֱ���Σ�SO2����ΪCO2�ǷǼ��Է��ӣ�SO2��H2O���Ǽ��Է��ӣ����ݡ��������ܡ�ԭ����SO2��H2O�е��ܽ�Ƚϴ�
��2��Q�ĺ˵����Ϊ24���Ǹ�Ԫ�أ����ݵ��ӵĺ����Ų����ɣ��������ԭ�����������Ų�ʽΪ1s22s22p63s23p63d54s1���۲������λ6�������������Ϊ+6�ۣ�
�ʴ�Ϊ��Cr��1s22s22p63s23p63d54s1��+6��
��3����HF����Һ�У��������������F��H��O��H֮���γ�������ɱ�ʾΪF-H��F��F-H��O��O-H��F��O-H��O��
�ʴ�Ϊ��F-H��F��F-H��O��O-H��F��O-H��O��
��4��F���⻯����һ�ּ������壬ӦΪNH3����FΪNԪ�أ�F���������γ����ӻ�����FH5����ӦΪNH4H��Ϊ���ӻ��������ʽΪ ��
��
�����к��е������Ӹ���Ϊ1�������Ӹ���Ϊ =1���������к���һ����NH4H���ӡ����辧���ı߳�Ϊacm������
=1���������к���һ����NH4H���ӡ����辧���ı߳�Ϊacm������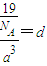 ��a=
��a= ����������������������֮�����̾���Ϊ��������ĵľ��룬Ϊ
����������������������֮�����̾���Ϊ��������ĵľ��룬Ϊ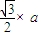 =
= ��
��
�ʴ�Ϊ�� ��
�� ��
��
���������⿼���Ϊ�ۺϣ��漰ԭ�ӽṹ��Ԫ��������֪ʶ�Լ������ļ��㡢�����֪ʶ����Ŀ�ѶȽϴ�ע�����þ�̯���жϾ������⣮
F�����γ����ӻ�����FH5��ӦΪNH4H��Ϊ���ӻ���������к���һ����NH4H���ӡ����辧���ı߳�Ϊacm������
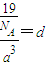 ��a=
��a= ����������������������֮�����̾���Ϊ��������ĵľ��룬Ϊ
����������������������֮�����̾���Ϊ��������ĵľ��룬Ϊ =
= ��
������⣺���ݵ��ӵĺ����Ų����ɣ��������ԭ������Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ������Ų�ʽΪ1s22s22p63s23p4����XΪ��Ԫ�أ�Yԭ�Ӻ����L���������K�������������6�����ӣ�YΪ̼Ԫ�أ�Z�ǵؿ��ں�����������������ߵ�Ԫ��Ϊ��Ԫ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�Q�ĺ˵����Ϊ24���Ǹ�Ԫ�أ���Ԫ�����ڱ��ĸ�Ԫ���е縺�������Ƿ�Ԫ�أ���EΪFԪ�أ�
��1��XZ2��YZ2����ΪSO2��CO2��SO2�ļ۲���Ӷ�Ϊ3�����йµ��Ӷ�Ϊ
 =1��SO2����2���ļ������ӵ����幹��ΪV�Σ�CO2�ļ۲���Ӷ�Ϊ2������2���ļ������ӵ����幹��Ϊֱ���Σ�CO2�ǷǼ��Է��ӣ�SO2��H2O���Ǽ��Է��ӣ����ݡ��������ܡ�ԭ����SO2��H2O�е��ܽ�Ƚϴ�
=1��SO2����2���ļ������ӵ����幹��ΪV�Σ�CO2�ļ۲���Ӷ�Ϊ2������2���ļ������ӵ����幹��Ϊֱ���Σ�CO2�ǷǼ��Է��ӣ�SO2��H2O���Ǽ��Է��ӣ����ݡ��������ܡ�ԭ����SO2��H2O�е��ܽ�Ƚϴ��ʴ�Ϊ��V�Σ�ֱ���Σ�SO2����ΪCO2�ǷǼ��Է��ӣ�SO2��H2O���Ǽ��Է��ӣ����ݡ��������ܡ�ԭ����SO2��H2O�е��ܽ�Ƚϴ�
��2��Q�ĺ˵����Ϊ24���Ǹ�Ԫ�أ����ݵ��ӵĺ����Ų����ɣ��������ԭ�����������Ų�ʽΪ1s22s22p63s23p63d54s1���۲������λ6�������������Ϊ+6�ۣ�
�ʴ�Ϊ��Cr��1s22s22p63s23p63d54s1��+6��
��3����HF����Һ�У��������������F��H��O��H֮���γ�������ɱ�ʾΪF-H��F��F-H��O��O-H��F��O-H��O��
�ʴ�Ϊ��F-H��F��F-H��O��O-H��F��O-H��O��
��4��F���⻯����һ�ּ������壬ӦΪNH3����FΪNԪ�أ�F���������γ����ӻ�����FH5����ӦΪNH4H��Ϊ���ӻ��������ʽΪ
 ��
�������к��е������Ӹ���Ϊ1�������Ӹ���Ϊ
 =1���������к���һ����NH4H���ӡ����辧���ı߳�Ϊacm������
=1���������к���һ����NH4H���ӡ����辧���ı߳�Ϊacm������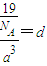 ��a=
��a= ����������������������֮�����̾���Ϊ��������ĵľ��룬Ϊ
����������������������֮�����̾���Ϊ��������ĵľ��룬Ϊ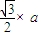 =
= ��
���ʴ�Ϊ��
 ��
�� ��
�����������⿼���Ϊ�ۺϣ��漰ԭ�ӽṹ��Ԫ��������֪ʶ�Լ������ļ��㡢�����֪ʶ����Ŀ�ѶȽϴ�ע�����þ�̯���жϾ������⣮

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
 ����ѧ--ѡ�����ʽṹ�����ʡ�
����ѧ--ѡ�����ʽṹ�����ʡ�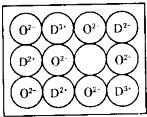 ����ѧ-ѡ�����ʽṹ�����ʡ�
����ѧ-ѡ�����ʽṹ�����ʡ�