题目内容
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化)
实验编号 | 起始浓度/(mol·L-1) | 反应后溶 液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A. 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B. 实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
【答案】B
【解析】试题分析:A、根据表中①的数据说明HA为弱酸,由此说明表中②的X>0.2;实验①反应后恰好生成KA,少量A-发生水解,则该溶液中c(K+)>c(A-)>c(OH-)>c(H+),A正确;B、据电荷守恒在该溶液中各离子浓度的关系式为c(K+)+c(H+)=c(A-)+c(OH-),则c(OH-)=c(K+)+c(H+)-c(A-),B错误;C、由于X>0.2,当一元酸HA的溶液和KOH溶液等体积混合,据物料守恒得c(A-)+c(HA)>0.1mol·L-l,C正确;D、实验②反应后的溶液中除了有KA,还有过量的HA,再据电荷守恒得:c(K+)=c(A-)>c(OH-)=c(H+),D正确;答案选B。

【题目】CaS可用于制备发光漆、用作脱毛剂、杀虫剂、硫脲等,还用于医药工业、重金属处理及环保中。某化学探究小组在实验室中利用反应:
CaSO4+C![]() CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:
CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下。回答下列问题:

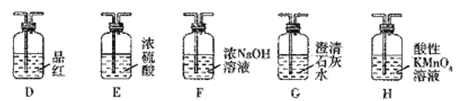
已知:①C及E ~ H中的试剂均为足量。
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S。
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为______(按气流方向,填字母组合),生成物中存在CO的现象是________________________。
(2)实验2:若只检验生成物中是否含有CO2,可釆用的最简单的装置组合为______(按气流方向,填字母组合),除去SO2的离子方程式为__________________________。
(3)实验3:若同时检验CO2和SO2,采用的装置组合为_______ (按气流方向,填字母组合)。
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如下表:
实验前 | 实验后 | |
实验1 | 装置C硬质玻璃管连同CuO质量为26.80 g | 装置C硬质玻璃管连同反应后固体质量为26.64 g |
实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38 g |
实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24 g |
写出CaSO4和焦炭在高温条件下反应生成CaS的化学方程式:_______________。
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过____操作,称得固体质量为m2,则表示硫化钙组成的计算式为n(Ca):n(S)=__________(用含m1 、m2的代数式表示)。
