题目内容
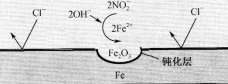
【题目】银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确是
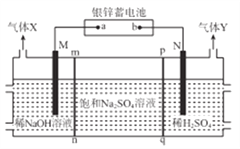
A. 电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-
B. 气体Y为H2
C. pq膜适宜选择阳离子交换膜
D. 电池中消耗65gZn,理论上生成1mol气体X
【答案】D
【解析】用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,根据装置图可知,该电解池的左侧为NaOH溶液,右侧为H2SO4溶液,说明M电极为阴极,水电离的H+在M电极上得电子生成H2,电极反应式为:2H2O+2e-=H2↑+2OH-,中间隔室的Na+通过mn膜进入装置左侧区域与生成的OH-结合生成NaOH,N电极为阳极,水电离的OH-在N电极上失电子生成O2,电极反应式为:2H2O-4e-=O2↑+4H+,中间隔室的SO42-通过pq膜进入装置右侧区域与生成的H+结合生成H2SO4。A. 根据上述分析可知,M为阴极,则a为负极、b为正极,a电极的反应式为Zn-2e-+2OH-=Zn(OH)2,故A错误;B. N电极的反应式为2H2O-4e-=O2↑+4H+,气体Y为O2,故B错误;C. 因中间隔室的SO42-通过pq膜进入装置右侧区域与生成的H+结合生成H2SO4,则pq膜应选择阴离子交换膜,故C错误;D. 65gZn的物质的量为1mol,当消耗65gZn时,转移电子的物质的量为2mol,M电极的反应式为2H2O+2e-=H2↑+2OH-,由反应式可知,当转移2mol电子时,生成H2的物质的量为1mol,故D正确;答案选D。

练习册系列答案
相关题目