题目内容
(1)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O
反应中氧化剂是 ,氧化产物是 ;当有lmol电子发生转移时,生成氯气的体积(标准状况) 。
(2)在一定条件下,RO3n-和氯气可发生如下反应:
RO3n-+C12+2OH-="===" RO4-+2C1-+H2O
由以上反应可知在上过程中RO3n-被 (填“氧化”或“还原”),RO3n-中元素R的化合价是 。
2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O
反应中氧化剂是 ,氧化产物是 ;当有lmol电子发生转移时,生成氯气的体积(标准状况) 。
(2)在一定条件下,RO3n-和氯气可发生如下反应:
RO3n-+C12+2OH-="===" RO4-+2C1-+H2O
由以上反应可知在上过程中RO3n-被 (填“氧化”或“还原”),RO3n-中元素R的化合价是 。
(共8分) (1) KMnO4(1分), Cl2(1分), 11.2L (2分)
(2)氧化(2分), +5 (2分)
(2)氧化(2分), +5 (2分)
试题分析:(1)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素所在的HCl反应物是还原剂,化合价降低的Mn元素所在的反应物KMnO4是氧化剂,氧化产物是Cl2。
反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,参加反应的16mol盐酸中,只有10mol盐酸被氧化,转移电子为10mol,当有0.10mol电子发生转移时,则有0.1molHCl被氧化,生成0.05mol的Cl2,即11.2L。
(2)根据电荷守恒,计算n=1,在RO3-中R是+5价,RO4-中R是+7价,化学价升高,被氧化。
点评:本题考查学生氧化还原反应中的基本概念和电子转移知识,可以根据所学知识进行回答,难度不大。

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目


 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O 离子在一定条件下可以把Mn2+离子氧化为
离子在一定条件下可以把Mn2+离子氧化为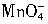 ,若反应后
,若反应后 离子变为
离子变为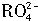 离子,
离子,