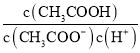题目内容
【题目】(1)把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红。填空完成问题:
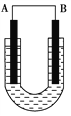
①A是原电池的_______极,代表金属____(填“铜”或“铁”);
②电极方程式分别为正极:______________________,原电池反应为_____________________________________。
(2)请从图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。
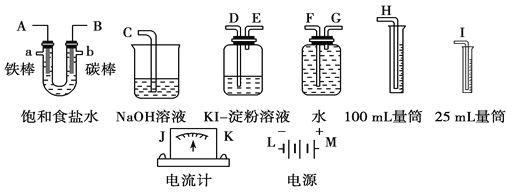
①A极发生的电极反应式是________________,B极发生的电极反应式是_______________。
②设计上述气体实验装置时,各接口的正确连接顺序为_________________________________________________________。
③实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为______________________。
【答案】 正 铜 O2+2H2O+4e-===4OH- 2Fe+O2+2H2O===2Fe(OH)2 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ H,F,G,A,B,D,E,C Cl2+2I-===2Cl-+I2
【解析】(1)①正极附近生成氢氧根离子,酚酞遇碱变红色,在A极观察到酚酞变红,说明A为正极,则A为金属铜;故答案为:正;铜;
②该原电池中,Fe易失电子发生氧化反应而作负极,电极反应式为:Fe-2e-=Fe2+,Cu作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=40H-,正极附近生成氢氧根离子,两电极反应式相加即为总反应2Fe+O2+2H2O═2Fe(OH)2,故答案为:O2+2H2O+4e-═4OH-;2Fe+O2+2H2O═2Fe(OH)2;
(2)①A是阴极、B是阳极,用惰性电极电解饱和食盐水时,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,所以阴极、阳极电极反应式分别为2H++2e-=H2↑、2Cl--2e-=Cl2↑,故答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;
②电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,相应装置的作用:![]() 所以其连接顺序是:H←F←G←A,B→D→E→C,故答案为:H,F,G,A,B,D,E,C;
所以其连接顺序是:H←F←G←A,B→D→E→C,故答案为:H,F,G,A,B,D,E,C;
③氯气和碘离子发生置换反应生成碘和氯离子,离子方程式为Cl2+2I-=I2+2Cl-,故答案为:Cl2+2I-=I2+2Cl-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比为1:3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆