题目内容
【题目】向10mL一定物质的量浓度的盐酸中滴加一定物质的量浓度的NaOH溶液,其pH变化如图所示,则两溶液的物质的量浓度分别是( )
A | B | C | D | |
盐酸的物质的量浓度 | 0.12 | 0.04 | 0.03 | 0.09 |
NaOH的物质的量浓度 | 0.04 | 0.12 | 0.09 | 0.03 |
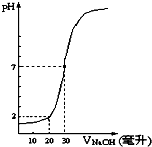
A.A
B.B
C.C
D.D
【答案】D
【解析】解:氢氧化钠和盐酸都是一元强电解质,设氢氧化钠的浓度为x,以上的浓度为y,当向10mL盐酸中加入20mL氢氧化钠溶液时,溶液的pH=2,二者反应后溶液显示酸性,反应后溶液中氢离子浓度为:c(H+)=0.01mol/L= ![]() mol/L,整理可得:①10x﹣20y=0.3;
mol/L,整理可得:①10x﹣20y=0.3;
当加入30mL氢氧化钠溶液时,二者恰好完全反应,溶液显示中性,n(HCl)=n(NaOH),则:②0.01x=0.03y,即x=3y,
由①②联立解得:x=0.09,y=0.03,
故选D.

练习册系列答案
相关题目