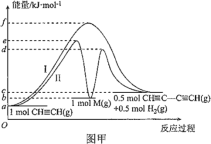
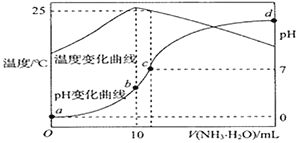
题目内容
【题目】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向![]() 溶液中滴加少量氯水,再加入
溶液中滴加少量氯水,再加入![]() 溶液振荡,静置,有机层呈橙色
溶液振荡,静置,有机层呈橙色
【答案】C
【解析】
A. Fe3+只存在于强酸性溶液中,在中性溶液中Fe3+已沉淀完全,A项错误;
B. 依据还原性强弱,I-优先反应,其次才是Fe2+。依据离子方程式2I-+Cl2=I2+2Cl-,溶液中0.8molI-完全反应需消耗0.4molCl2,而现在只通入0.3mol,所以Fe2+没有参与反应,离子反应方程式为:2I-+Cl2=I2+2Cl-,B项错误;
C. 从题给信息可知次氯酸的酸性大于HCO3-,所以向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-,注意不能生成CO32-,因为HClO能与CO32-继续反应生成HCO3-,C项正确;
D. 氯气先与Fe2+反应,再与Br-反应。所以滴加少量的氯水,并不会生成溴单质,而是发生反应:2Fe2++Cl2=2Fe3++2Cl-,D项错误;
所以答案选择C项。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目