题目内容
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:H2O2+2Fe3+=2Fe2++O2↑+2H+,H2O2+2Fe2++2H+=2Fe3++2H2O.在以上反应中Fe3+实际上起着
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:H2O2+I2=2HIO,
总反应式为
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色.该反应的离子方程式为:
(4)铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
(5)铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:Fe2O3+NaNO3+NaOH→Na2FeO4+NaNO2+H2O
配平化学方程式,并标出电子转移的方向和数目.
分析:(1)由H2O2+2Fe3+=2Fe2++O2↑+2H+,H2O2+2Fe2++2H+=2Fe3++2H2O相加合得到总反应式,由总反应式确定Fe3+实际起的作用;
(2)I2和Fe2+一样也能与H2O2发生上述类似反应,则总反应为2H2O2═O2↑+2H2O,以此分析两步反应;
(3)放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色均可说明反应生成了碘单质;
(4)在反应中Na2FeO4被还原为Fe3+离子,Fe3+水解得到的氢氧化铁胶体具有吸附性;
(5)根据“化合价升降相等”配平氧化剂、还原剂和还原产物、氧化产物,依据原子守恒完成最终配平,利用单线桥标出转移电子数目.
(2)I2和Fe2+一样也能与H2O2发生上述类似反应,则总反应为2H2O2═O2↑+2H2O,以此分析两步反应;
(3)放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色均可说明反应生成了碘单质;
(4)在反应中Na2FeO4被还原为Fe3+离子,Fe3+水解得到的氢氧化铁胶体具有吸附性;
(5)根据“化合价升降相等”配平氧化剂、还原剂和还原产物、氧化产物,依据原子守恒完成最终配平,利用单线桥标出转移电子数目.
解答:解:(1)由H2O2+2Fe3+=2Fe2++O2↑+2H+,H2O2+2Fe2++2H+=2Fe3++2H2O相加合得总反应式 2H2O2═O2↑+2H2O,由此可见Fe3+实际上起作为催化剂,
故答案为:催化; 2H2O2═O2↑+2H2O;
(2)I2和Fe2+一样也能与H2O2发生上述类似反应,则总反应为2H2O2═O2↑+2H2O,则两步反应为H2O2+I2═2HIO、2HIO+H2O2=I2+O2↑+2H2O,
故答案为:2HIO+H2O2=I2+O2↑+2H2O;2H2O2═O2↑+2H2O;
(3)放出大量气体为反应生成的碘单质催化H2O2分解,溶液呈棕色,并可使淀粉变蓝色均可说明反应生成了碘单质,反应物为H2O2、I-和H+,产物为I2和水,离子方程式为:H2O2+2H++2I-=I2+2H2O,
故答案为:H2O2+2H++2I-=I2+2H2O;
(4)在反应中Na2FeO4被还原为Fe3+离子,Fe3+水解得到的氢氧化铁胶体具有吸附性,可以用于净水,
故答案为:生成的Fe3+离子水解可产生Fe(OH)3胶体,吸附水中悬浮的杂质;
(5)Fe2O3→Na2FeO4,Fe化合价升高3×2,NaNO3→NaNO2 N化合价降低2,根据化合价升降相等,故Fe2O3化学计量数为1、NaNO3化学计量数为3,氧化产物Na2FeO4化学计量数为2、NaNO2化学计量数为3,依据原子守恒可知NaOH化学计量数为4、H2O的化学计量数为2,故方程式为:Fe2O3+3NaNO3+4NaOH═2Na2FeO4+3NaNO2+2H2O;Fe2O3→Na2FeO4,Fe化合价升高3×2,失去的电子数为6,用单线桥表示为: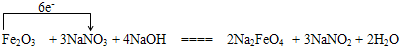 ,
,
故答案为: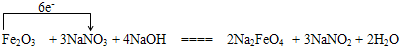 .
.
故答案为:催化; 2H2O2═O2↑+2H2O;
(2)I2和Fe2+一样也能与H2O2发生上述类似反应,则总反应为2H2O2═O2↑+2H2O,则两步反应为H2O2+I2═2HIO、2HIO+H2O2=I2+O2↑+2H2O,
故答案为:2HIO+H2O2=I2+O2↑+2H2O;2H2O2═O2↑+2H2O;
(3)放出大量气体为反应生成的碘单质催化H2O2分解,溶液呈棕色,并可使淀粉变蓝色均可说明反应生成了碘单质,反应物为H2O2、I-和H+,产物为I2和水,离子方程式为:H2O2+2H++2I-=I2+2H2O,
故答案为:H2O2+2H++2I-=I2+2H2O;
(4)在反应中Na2FeO4被还原为Fe3+离子,Fe3+水解得到的氢氧化铁胶体具有吸附性,可以用于净水,
故答案为:生成的Fe3+离子水解可产生Fe(OH)3胶体,吸附水中悬浮的杂质;
(5)Fe2O3→Na2FeO4,Fe化合价升高3×2,NaNO3→NaNO2 N化合价降低2,根据化合价升降相等,故Fe2O3化学计量数为1、NaNO3化学计量数为3,氧化产物Na2FeO4化学计量数为2、NaNO2化学计量数为3,依据原子守恒可知NaOH化学计量数为4、H2O的化学计量数为2,故方程式为:Fe2O3+3NaNO3+4NaOH═2Na2FeO4+3NaNO2+2H2O;Fe2O3→Na2FeO4,Fe化合价升高3×2,失去的电子数为6,用单线桥表示为:
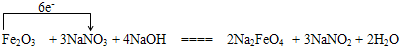 ,
,故答案为:
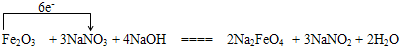 .
.点评:本题考查催化剂的作用和过氧化氢的氧化性,涉及氧化还原反应的配平、转移电子数目、方向的表示方法以及净水,铁酸钠为近几年的高频考点.

练习册系列答案
相关题目
 Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物.
Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物.