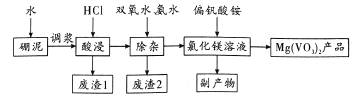
��Ŀ����
����Ŀ�����仯�����������������ж���������Ҫ�����á�
��1��SO2���γ��������Ҫ��Ⱦ�ȼú�����ԭ��Ϊ
2CaO(s)+2SO2(s)+O2(g)![]() 2CaSO4(s)
2CaSO4(s)
��10L���º����ܱ������м���3mol CaO,��ͨ��2mol SO2��lmol O2����������Ӧ��2minʱ��ƽ�⣬��ʱCaSO4Ϊl.8mol��02min�ڣ���SO2��ʾ�ĸ÷�Ӧ������v(SO2)=_________________�������������ֲ��䣬��������Ӧ�ں�ѹ�����½��У��ﵽƽ��ʱSO2��ת����________(���������С�����䡱)��
��2��25��ʱ��H2SO3�ĵ��볣��Kal=1��10-2, Ka2=6��10-8������¶���NaHSO3��ˮ��ƽ�ⳣ��Kb=_____________���ж�NaHSO3��Һ��________�ԣ���ᡱ��������С������ü�Ҫ��������ԭ����_______________________________��
��3��Na2SO3��Һ��Ϊ����Һ���ѳ������е�SO2��������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£�
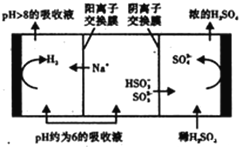
HSO3-�������ŵ�ʱ�ĵ缫��Ӧʽ��________________________________��
��4�����á���ѧ����ת�Ʒ����Ʊ�TaS2���壬�������·�Ӧ
TaS2(s)+2I2(g)![]() TaI4(g)+S2(g) ��H>0
TaI4(g)+S2(g) ��H>0
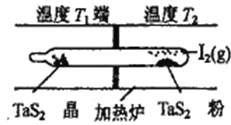
����ͼ��ʾ��������Ӧ��ʯӢ��չ��н��У������¶�ΪT2��һ�˷���δ�ᴿ��TaS2��ĩ������I2 (g)������ʱ����ڜض�ΪT1��һ�˵õ��˴�����TaS2���壬���¶�T1 ______T2 ���>����<����=����������Ӧ��ϵ��ѭ��ʹ�õ�������__________________________��
���𰸡� 0.09mol/(L��min) ���� 1��10-12 ���� HSO3-�������ˮ�� HSO3-+H2O-2e-��SO42- +3H+ < I2
����������1�����⿼�黯ѧ��Ӧ���ʵļ���ͻ�ѧƽ����ƶ�������CaSO4���ʵ���Ϊ1.8mol��ͬʱ����SO2�����ʵ���Ϊ1.8mol�����ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(SO2)=1.8/(10��2)mol/(L��min)=0.09 mol/(L��min)��������Ӧ������У��������ʵ�����С��ά�ֺ�ѹ���䣬SO2��ת���ʱȺ���ʱ����2��������Һ������ƽ�ⳣ���Ĺ�ϵ������Һ����Ե��жϣ�NaHSO3ˮ�ⳣ���ı���ʽKh= 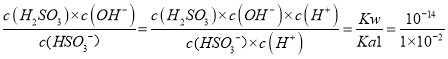 =1��10��12�� NaHSO3��ˮ�ⳣ��С��HSO3���ĵ��볣������˴���Һ�����ԣ���3����������е缫��Ӧʽ����д��HSO3���������Ϸŵ磬ʧȥ���ӣ�S�Ļ��ϼ����ߣ�ת����SO42�����缫��ӦʽΪHSO3����2e����H2O=SO42����3H������4�����黯ѧƽ����ƶ����˷�Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ������У���T1�¶�ʱ�õ�������TaS2��˵��T1���¶ȵ���T2�����ݷ���ʽ������ѭ��ʹ�õ�������I2��
=1��10��12�� NaHSO3��ˮ�ⳣ��С��HSO3���ĵ��볣������˴���Һ�����ԣ���3����������е缫��Ӧʽ����д��HSO3���������Ϸŵ磬ʧȥ���ӣ�S�Ļ��ϼ����ߣ�ת����SO42�����缫��ӦʽΪHSO3����2e����H2O=SO42����3H������4�����黯ѧƽ����ƶ����˷�Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ������У���T1�¶�ʱ�õ�������TaS2��˵��T1���¶ȵ���T2�����ݷ���ʽ������ѭ��ʹ�õ�������I2��