题目内容
3.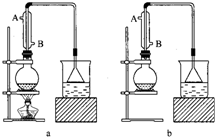 实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O
已知反应物的用量:0.3mol NaBr(s);0.25mol乙醇;36mL浓硫酸(溶质质量分数为98%,密度为1.84g•mL-1);25mL水,其中乙醇的密度为0.80g•mL-1.回答下列问题:
(1)该实验应选择下图中的 (填“a”或“b”)装置.a
(2)反应装置中的烧瓶应选择下列哪种规格最合适C
A.50mLB.100mLC.150mLD.250mL
(3)冷凝管中的冷凝水的流向应是B
A.A进B出B.B进A出C.从A进或B进均可
(4)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有C2H5Br、C2H5OC2H5和Br2.
(5)用棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是NaOH溶液,必须使用的仪器是分液漏斗.
(6)本实验的产率为60%,则可制取溴乙烷16.35g.
(7)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏.为证明最终得到的产品--溴乙烷中含有溴元素,下列几项实验步骤,其正确的操作顺序是:取少量溴乙烷,然后④①⑤③②(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却.
分析 (1)根据a、b装置的不同点进行解答;
(2)根据相关数据计算,加热时烧瓶内液体的体积应小于烧瓶容积;
(3)从冷凝的原理出发解答;
(4)根据该反应过程发生的副反应及反应产物分析;
(5)溴乙烷中含有单质溴显棕黄色,根据溴单质的性质选择除杂试剂;根据分离互不相溶的液体的操作分析;
(6)已知n(乙醇)=0.25mol,然后根据方程式结合转化率来解答;
(7)溴乙烷在碱性条件下水解生成乙醇和NaBr,中和多余的碱,然后用硝酸银检验溴离子.
解答 解:(1)由题给信息,知该反应为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,反应需要加热,所以应采用装置a,
故答案为:a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的$\frac{2}{3}$,
V(C2H5OH)=$\frac{0.25mol×46g•mo{l}^{-1}}{0.80g•c{m}^{-3}}$=14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,
故答案为:C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出.
故答案为:B;
(4)可能发生的副反应有:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$C2H4↑+H2O,2C2H5OH $→_{140℃}^{浓H_{2}SO_{4}}$C2H5OC2H5+H2O,2HBr+H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$Br2+SO2↑+2H2O等,
则反应产物混合液中含有C2H5Br、C2H5OC2H5和Br2,所以将烧瓶中的有机物蒸馏出来,所得馏出液中含有C2H5Br、C2H5OC2H5和Br2.
故答案为:C2H5Br、C2H5OC2H5和Br2;
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用NaOH溶液洗涤除去,溴乙烷难溶于水,可以用分液漏斗分离溴乙烷和水溶液;
故答案为:NaOH溶液;分液漏斗
(6)已知n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,
反应方程式为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,
则m(溴乙烷)=0.15mol×109g/mol=16.35g,
故答案为:16.35.
(7)溴乙烷与氢氧化钠溶液混合加热,溴乙烷水解生成乙醇和NaBr,然后加硝酸中和多余的碱,再向溶液中加硝酸银,生成浅黄色沉淀,说明含有溴离子,即溴乙烷中含有溴元素,所以正确的操作顺序是④①⑤③②;
故答案为:④①⑤③②.
点评 本题主要考查了溴乙烷的制备,侧重于实验制备方案设计、物质的分离提纯、有关方程式的计算等,注意掌握相关物质的基本化学性质、明确实验目的是解答本题的关键,平时须注意积累相关反应知识,难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 鉴别苯与甲苯可用酸性高锰酸钾溶液 | |
| B. | 油脂和蛋白质都是能发生水解反应的高分子化合物 | |
| C. | 有机物CH3CH=CHCl存在顺反异构现象 | |
| D. | 有机物 中所有原子可能处于同一平面 中所有原子可能处于同一平面 |
| A. | 两种盐溶液混合就一定能生成两种新盐 | |
| B. | 金属和酸都能发生置换反应生成氢气 | |
| C. | 金属与盐溶液反应一定得到金属和新盐 | |
| D. | 碱性氧化物加入水后不一定生成碱 |
| A. | Cl2的摩尔质量等于它的相对分子质量 | |
| B. | 1mol H2O的质量是18g | |
| C. | 氧气的摩尔质量是32g | |
| D. | 2g H2含1mol H |


 如图表示反应N2(g)+3H2(g)?2NH3(g);△H<0 在某一时间段反应速率与反应过程的曲线关系图,
如图表示反应N2(g)+3H2(g)?2NH3(g);△H<0 在某一时间段反应速率与反应过程的曲线关系图,