题目内容
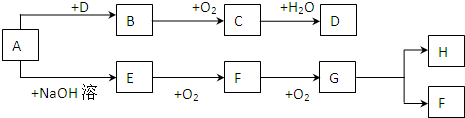
已知A是盐类物质(正盐),从A的水溶液出发有下图所示的一系列变化:

试回答:
(1)物质的化学式:A
(2)写出A→D的离子方程式
(3)写出E→F的离子方程式
(4)鉴定物质F的方法

试回答:
(1)物质的化学式:A
(NH4)2SO3
(NH4)2SO3
,CSO2
SO2
,DNH3
NH3
.(2)写出A→D的离子方程式
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
(3)写出E→F的离子方程式
SO32-+Br2+H2O=SO42-+2Br-+2H+
SO32-+Br2+H2O=SO42-+2Br-+2H+
.(4)鉴定物质F的方法
通过焰色反应鉴定(隔蓝色钴玻璃,火焰呈紫色);取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在
通过焰色反应鉴定(隔蓝色钴玻璃,火焰呈紫色);取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在
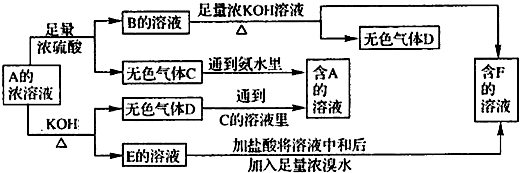
.分析:由C+氨水→A,D+C的溶液→A,知D为NH3,则A为铵盐,由A可跟酸反应,又可与碱反应且A为正盐且为弱酸弱碱盐,A与浓硫酸反应生成B是(NH4)2SO4,推知F为K2SO4,E为K2SO3,
C为SO2,即A为(NH4)2SO3,B为(NH4)2SO4,C为SO2,D为NH3,E为K2SO3,F为K2SO4,结合物质的性质解答该题.
C为SO2,即A为(NH4)2SO3,B为(NH4)2SO4,C为SO2,D为NH3,E为K2SO3,F为K2SO4,结合物质的性质解答该题.
解答:解:(1)由C+氨水→A,D+C的溶液→A,知D为NH3,则A为铵盐,由A可跟酸反应,又可与碱反应且A为正盐且为弱酸弱碱盐,A与浓硫酸反应生成B是(NH4)2SO4,推知F为K2SO4,E为K2SO3,C为SO2,即A为(NH4)2SO3,B为(NH4)2SO4,C为SO2,D为NH3,E为K2SO3,F为K2SO4,故答案为:(NH4)2SO3;SO2;NH3;
(2)A→D为(NH4)2SO3 和KOH的反应,反应的离子方程式为NH4++OH-
NH3↑+H2O,
故答案为:NH4++OH-
NH3↑+H2O;
(3)SO32-具有还原性,与具有氧化性的Br2发生氧化还原反应生成SO42-和Br-,
反应的离子方程式为SO32-+Br2+H2O=SO42-+2Br-+2H+,
故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+;
(4)可分别检验K+和SO42-,可用焰色反应鉴定K+,隔蓝色钴玻璃,火焰呈紫色,用BaCl2检验SO42-,具体做法为通过焰色反应鉴定K+(隔蓝色钴玻璃,火焰呈紫色);取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在,
故答案为:通过焰色反应鉴定K+(隔蓝色钴玻璃,火焰呈紫色);取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在.
(2)A→D为(NH4)2SO3 和KOH的反应,反应的离子方程式为NH4++OH-
| ||
故答案为:NH4++OH-
| ||
(3)SO32-具有还原性,与具有氧化性的Br2发生氧化还原反应生成SO42-和Br-,
反应的离子方程式为SO32-+Br2+H2O=SO42-+2Br-+2H+,
故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+;
(4)可分别检验K+和SO42-,可用焰色反应鉴定K+,隔蓝色钴玻璃,火焰呈紫色,用BaCl2检验SO42-,具体做法为通过焰色反应鉴定K+(隔蓝色钴玻璃,火焰呈紫色);取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在,
故答案为:通过焰色反应鉴定K+(隔蓝色钴玻璃,火焰呈紫色);取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在.
点评:本题考查无机物的推断,题目难度中等,本题注意A可跟酸反应,又可与碱反应且A为正盐且为弱酸弱碱盐这一点,为解答该题的关键,也是易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目