题目内容
【题目】完成下列计算:
(1)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)相同质量的SO2、SO3的氧原子的个数之比为___________。
(3)1/28 mol N2含有a个N原子,则阿伏加德罗常数可以表示为___________mol-1。
(4)4.6g Na单质变成Na+,会失去__________mol的电子
(5)已知VmL的Fe2(SO4)3溶液中含SO42- a g,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为______________。
【答案】 0.4NA或2.408×1023 5:6 14a 0.2 125a/288V
【解析】(1)0.3 mol NH3分子中所含原子的物质的量是0.3mol×4=1.2mol,因此含有相同原子数的水分子的物质的量是1.2mol÷3=0.4mol,个数是0.4NA。(2)相同质量的SO2、SO3的氧原子的个数之比为![]() =5:6。(3)1/28 mol N2含有a个N原子,氮原子的物质的量是
=5:6。(3)1/28 mol N2含有a个N原子,氮原子的物质的量是![]() ,则
,则![]() ,即阿伏加德罗常数可以表示为14amol-1。(4)4.6g Na的物质的量是4.6g÷23g/mol=0.2mol,单质变成Na+,会失去0.2mol的电子;(5)硫酸根的物质的量是
,即阿伏加德罗常数可以表示为14amol-1。(4)4.6g Na的物质的量是4.6g÷23g/mol=0.2mol,单质变成Na+,会失去0.2mol的电子;(5)硫酸根的物质的量是![]() ,根据化学式可知铁离子的物质的量是
,根据化学式可知铁离子的物质的量是![]() ,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为
,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为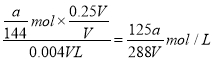 。
。

练习册系列答案
相关题目
