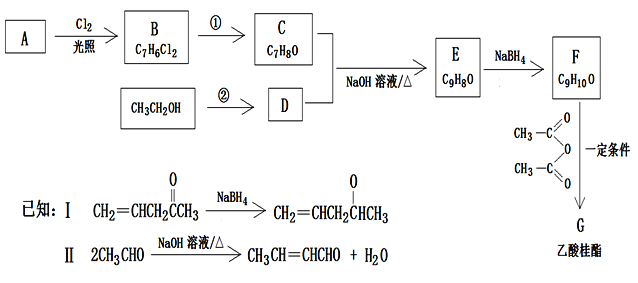
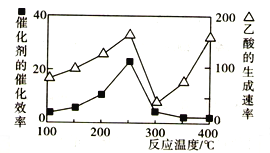
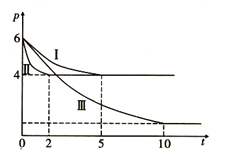
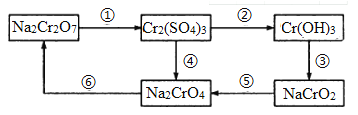
题目内容
【题目】镭是周期表中第7周期第ⅡA主族元素,下列关于镭的性质描述中不正确的是( )
A.在化合物中呈+2价
B.镭比钙的金属性强
C.氢氧化物呈两性
D.碳酸盐难溶于水
【答案】C
【解析】解:A.镭最外层有2个电子,在化合物中呈+2价,故A正确; B.同主族元素从上到下金属性逐渐增强,镭的金属性较强,故B正确;
C.同主族元素从上到下金属性逐渐增强,镭的金属性比Ba强,镭的氢氧化物应是强碱,故C错误;
D.同主族元素性质相似,碳酸钙不溶于水,则碳酸镭难溶于水,故D正确,
故选C.

练习册系列答案
相关题目