题目内容
Ag2O2是银锌碱性电池的正极活性物质,电解质溶液为KOH溶液,电池放电时总反应方程式为:Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag.下列有关该电池的说法正确的是( )
| A、该电池正极反应式为:Ag2O2+2e-+2H2O=2Ag+4OH- |
| B、放电时负极区溶液的pH逐渐变大 |
| C、K2Zn(OH)4是还原产物,Ag是氧化产物 |
| D、每生成1mol K2Zn(OH)4转移2mol电子 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,正极电极反应式为Ag2O2+4e-+2H2O═2Ag+4OH-,负极电极反应式为2Zn-4e-+8OH-═2Zn(OH)42-,据此分析解答.
解答:
解:A.正极上Ag2O2得电子发生还原反应,电极反应为Ag2O2+4e-+2H2O═2Ag+4OH-,故A错误;
B.放电时,负极电极反应式为2Zn-4e-+8OH-═2Zn(OH)42-,氢氧根离子参加反应,则溶液的碱性减小,所以负极区域溶液的PH减小,故B错误;
C.该反应中Zn失电子化合价升高、Ag元素得电子化合价降低,则K2Zn(OH)4是氧化产物,Ag是还原产物,故C错误;
D.根据2Zn-4e-+8OH-═2Zn(OH)42-知,每生成1mol K2Zn(OH)4转移2mol电子,故D正确;
故选D.
B.放电时,负极电极反应式为2Zn-4e-+8OH-═2Zn(OH)42-,氢氧根离子参加反应,则溶液的碱性减小,所以负极区域溶液的PH减小,故B错误;
C.该反应中Zn失电子化合价升高、Ag元素得电子化合价降低,则K2Zn(OH)4是氧化产物,Ag是还原产物,故C错误;
D.根据2Zn-4e-+8OH-═2Zn(OH)42-知,每生成1mol K2Zn(OH)4转移2mol电子,故D正确;
故选D.
点评:本题考查了原电池原理,根据元素化合价变化确定正负极上发生的反应,难点是电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
32S和33S互为同位素,下列说法正确的是( )
| A、32S和33S 原子的最外层电子数均为2 |
| B、32S和33S具有相同的中子数 |
| C、32S和33S具有不同的电子数 |
| D、32S和33S具有相同的质子数 |
有一定质量的Zn与100mL 18mol/L的浓硫酸充分反应,Zn完全溶解,同时生成标准状况下的气体A 33.6L,则反应中转移电子的物质的量为( )
| A、3mol |
| B、1.5mol |
| C、2mol |
| D、1.8mol |
有一瓶无色气体可能含有CO2、HBr、NO2、HCl、SO2中的一种或几种.将此气体通入足量稀氯水中,恰好完全反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,以下结论正确的是( )
| A、不能确定原气体中是否含有SO2 |
| B、原气体中肯定有HCl |
| C、原气体中肯定没有CO2 |
| D、原气体中肯定没有HBr、NO2 |
关于乙烯基乙炔CH≡C-CH=CH2分子的说法错误的是( )
| A、能使酸性KMnO4溶液褪色 |
| B、等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
| C、乙烯基乙炔分子内含有两种官能团 |
| D、1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应 |
下列平衡体系在体积不变时加入所给物质,平衡可以发生移动的是( )
| A、FeCl3(aq)+KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体 |
| B、N2(g)+3H2(g)?2NH3(g),通入HCl气体 |
| C、CaCO3(s)?CaO(s)+CO2(g),加入CaCO3 |
| D、2SO2(g)+O2(g)?2SO3(g),通入N2 |
下列物质中阴离子和阳离子所具有的电子数相等的是( )
| A、Na2S |
| B、NaF |
| C、KCl |
| D、MgCl2 |
下列说法正确的是( )
| A、基态原子O层只有2个电子,则该原子N层的电子数肯定为8或18个 | ||
| B、核外电子数为奇数的基态原子,其原子轨道中一定含有未成对电子 | ||
C、R为第二周期元素,其原子具有的电子层数为最外层电子数的
| ||
| D、Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be |
下列判断中,正确的是( )
| A、CH3COONH4与H2N-CH2-COOH是同分异构体 |
| B、CH3CH2Cl与CH2ClCH3是同分异构体 |
| C、H2N-CH2-COOH与CH3-CH2-NO2是同分异构体 |
D、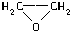 与CH3CHO是同分异构体 与CH3CHO是同分异构体 |