题目内容
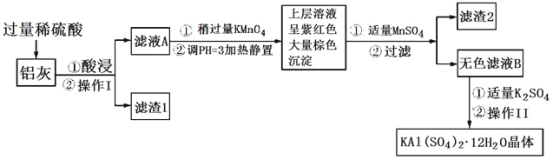
【题目】Ⅰ.某化学学习小组为探究NO2和SO2的反应进行如图所示实验。
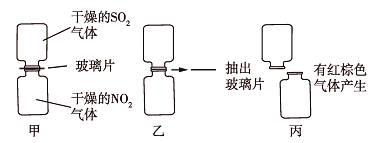
(1)图甲两集气瓶中__(填“上”或“下”)瓶气体颜色深。
(2)图乙中反应的现象是___。
(3)图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有__,NO2在该反应中显__性。
(4)由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:___。
Ⅱ.某课外活动小组欲探究镁与NO2的反应。已知镁与CO2的反应为2Mg+CO2![]() 2MgO+C。
2MgO+C。
(1)该小组类比Mg与CO2的反应对Mg与NO2的反应进行猜测,写出Mg与NO2反应的化学方程式:__。
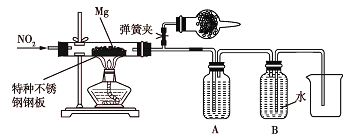
(2)该小组设计如下实验验证上述猜测,实验装置(用于连接玻璃管的乳胶管均内衬锡纸)如图所示。
资料信息:2NO2+2NaOH=NaNO2+NaNO3+H2O
①装置A中的试剂是__。
②干燥管和装置B的作用分别是__、__。
③正确的实验操作步骤是__。
a.通人NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
【答案】下 两气体混合后,红棕色消失 NO 氧化 NO2+SO2=NO+SO3 4Mg+2NO2![]() 4MgO+N2 NaOH溶液 吸收NO2避免污染环境 收集N2 badc
4MgO+N2 NaOH溶液 吸收NO2避免污染环境 收集N2 badc
【解析】
Ⅱ.该实验中先通入二氧化氮气体可排尽装置中的空气,此时打开弹簧夹,干燥管吸收多余的二氧化氮,然后关闭弹簧夹,之后点燃酒精灯,二氧化氮与镁单质发生反应,A装置中盛放氢氧化钠溶液可吸收为反应的二氧化氮,B装置短进长出且装满水,可用排水法收集反应生成的氮气。
I.(1)NO2呈红棕色,SO2为无色气体,故下瓶气体颜色深;
(2)NO2有强氧化性,能被SO2,还原成NO,则两气体混合后,红棕色消失;
(3)“有红棕色气体产生”说明SO2和NO2反应的产物中有NO,NO遇空气被氧化成NO2,SO2与NO2的反应中NO2体现了氧化性;
(4)NO2和SO2反应的化学方程式为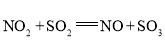 ;
;
Ⅱ.(1)由题意分析可知,Mg与NO2发生置换反应,反应的化学方程点燃式为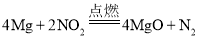 ;
;
(2)①由反应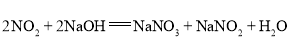 可知,装置A中的试剂是NaOH溶液,作用是除去N2中混有的NO2;
可知,装置A中的试剂是NaOH溶液,作用是除去N2中混有的NO2;
②干燥管的作用是吸收NO2避免污染环境。装置B是利用排水法收集N2的装置;
③正确的实验操作步骤是:打开弹簧夹→通入NO2(排尽装置中的空气)→当硬质玻璃管充满红棕色气体后,关闭弹簧夹,点燃酒精灯。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
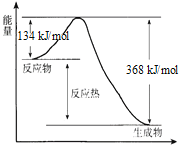
口算题卡河北少年儿童出版社系列答案【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度t的关系:
CO(g)+H2O(g),其平衡常数K和温度t的关系:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:_________;
(2)该反应的正反应为_________反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:_________。
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2)=c(CO)=c(H2)=c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是_________(填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率_________(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其可能原因是__________________________________________。
Ⅱ.设在容积可变的密闭容器中充入10molN2(g)和10molH2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。
(6)求该条件下反应N2(g)+3H2(g)![]() 2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。