题目内容
【题目】25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=﹣lgKa).在此温度下向20mL0.1molL﹣1H2R溶液中滴加0.1molL﹣1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示.
下列有关说法正确的是( )
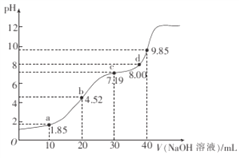
A. a点所示溶液中:c(H2R)+c(HR﹣)+c(R2﹣)=0.1molL﹣1
B. b点所示溶液中:c(Na+)>c(HR﹣)>c(H2R)>c(R2﹣)
C. c点所示溶液中:c(Na+)<3c(R2﹣)
D. d点所示溶液中:c(Na+)>c(R2﹣)>c(HR﹣)
【答案】D
【解析】A.a点溶液体积是原来的1.5倍,则含有R元素的微粒浓度是原来的2/3,根据物料守恒得c(H2R)+c(HR-)+c(R2-)=1/15molL-1,A错误;B.b点二者恰好完全反应生成NaHR,溶液呈酸性,说明HR-的电离程度大于水解程度,但其水解和电离程度都较小,钠离子不水解,所以离子微粒浓度大小顺序是c(Na+)>c(HR-)>c(R2-)>c(H2R),B错误;C.c点溶液溶质为等物质的量的Na2R、NaHR,如果Na2R、NaHR不水解且NaHR也不电离,则存在c(Na+)=3c(R2-),实际上R2-水解且HR-的电离程度大于水解程度,钠离子不水解,所以存在c(Na+)>3c(R2-),C错误;D.d点溶液中溶质为Na2R,R2-水解但程度较小,所以存在c(Na+)>c(R2-)>c(HR-),D正确;答案选D。

【题目】向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气。将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是
选项 | X溶液 | 现象 |
|
A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
D | 紫色石蕊溶液 | 溶液先变红后褪色 |
A. A B. B C. C D. D




