题目内容
I.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入图1装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极.
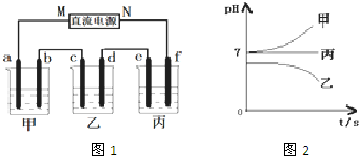
接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如图2(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式______;
(2)电极f上发生的电极反应为______;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是______.
II.工业上利用BaSO4制备BaCl2的工艺流程如下:

某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验.
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S.Na2S水溶液显碱性的原因是______(用离子方程式表示).
(2)已知有关反应的热化学方程式如下:
BaSO4(s)+4C(s)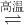 4CO(g)+BaS(s)△H1=+571.2kJ/mol
4CO(g)+BaS(s)△H1=+571.2kJ/mol
C(s)+CO2(g) 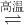 2CO(g)△H2=+172.5kJ/mol
2CO(g)△H2=+172.5kJ/mol
则反应BaSO4(s)+2C(s)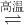 2CO2(g)+BaS(s)△H3=______kJ/mol
2CO2(g)+BaS(s)△H3=______kJ/mol
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是______,______.
解:Ⅰ.乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O 2Cu+O2↑+H2SO4,
2Cu+O2↑+H2SO4,
故答案为:2CuSO4+2H2O 2Cu+O2↑+H2SO4;
2Cu+O2↑+H2SO4;
(2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)= =0.125mol,转移0.25mol电子,
=0.125mol,转移0.25mol电子,
丙中发生2H2O O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
故答案为:向丙烧杯中加入水2.25g;
Ⅱ.(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主,第一步水解生成离子HS-,第二步水解生成H2S,水解的离子方程式分别为S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,
故答案为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(2)已知BaSO4(s)+4C(s)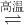 4CO(g)+BaS(s)△H1=+571.2kJ/mol
4CO(g)+BaS(s)△H1=+571.2kJ/mol
C(s)+CO2(g)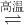 2CO(g)△H2=+172.5kJ/mol,
2CO(g)△H2=+172.5kJ/mol,
利用盖斯定律将①-2×②可得BaSO4(s)+2C(s)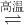 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
△H3=(+571.2kJ/mol)-2×(+172.5kJ/mol)=+226.2kJ/mol,
故答案为:+226.2;
(3)加入过量碳有利于硫酸钡充分反应,题中反应均为吸热反应,所以生成需要提供能量才能完成,本生产可以借助过量的碳和氧气燃烧为生产提供能量,维持高温条件,
故答案为:使BaSO4得到充分的还原(或提高BaS的产量);硫酸钡和碳反应为吸热反应,炭和氧气反应放热维持反应所需高温.
分析:Ⅰ.乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4;
Ⅱ.(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主;
(2)利用盖斯定律计算;
(3)加入过量C可提高冰晶石的转化率,同时维持反应进行.
点评:本题考查较为综合,涉及物质的制备方案的涉及以及电解原理等知识,注意电解中最关键的是准确判断出电极上离子的放电顺序.在判断电解产物时,首先判断阳极电极材料.如果是活性电极,则电极本身失去电子.如果是惰性电极,则溶液中的阴离子失去电子.而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序.
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O
 2Cu+O2↑+H2SO4,
2Cu+O2↑+H2SO4,故答案为:2CuSO4+2H2O
 2Cu+O2↑+H2SO4;
2Cu+O2↑+H2SO4; (2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)=
 =0.125mol,转移0.25mol电子,
=0.125mol,转移0.25mol电子,丙中发生2H2O
 O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,故答案为:向丙烧杯中加入水2.25g;
Ⅱ.(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主,第一步水解生成离子HS-,第二步水解生成H2S,水解的离子方程式分别为S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,
故答案为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(2)已知BaSO4(s)+4C(s)
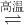 4CO(g)+BaS(s)△H1=+571.2kJ/mol
4CO(g)+BaS(s)△H1=+571.2kJ/molC(s)+CO2(g)
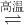 2CO(g)△H2=+172.5kJ/mol,
2CO(g)△H2=+172.5kJ/mol,利用盖斯定律将①-2×②可得BaSO4(s)+2C(s)
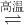 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)△H3=(+571.2kJ/mol)-2×(+172.5kJ/mol)=+226.2kJ/mol,
故答案为:+226.2;
(3)加入过量碳有利于硫酸钡充分反应,题中反应均为吸热反应,所以生成需要提供能量才能完成,本生产可以借助过量的碳和氧气燃烧为生产提供能量,维持高温条件,
故答案为:使BaSO4得到充分的还原(或提高BaS的产量);硫酸钡和碳反应为吸热反应,炭和氧气反应放热维持反应所需高温.
分析:Ⅰ.乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4;
Ⅱ.(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主;
(2)利用盖斯定律计算;
(3)加入过量C可提高冰晶石的转化率,同时维持反应进行.
点评:本题考查较为综合,涉及物质的制备方案的涉及以及电解原理等知识,注意电解中最关键的是准确判断出电极上离子的放电顺序.在判断电解产物时,首先判断阳极电极材料.如果是活性电极,则电极本身失去电子.如果是惰性电极,则溶液中的阴离子失去电子.而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序.

练习册系列答案
相关题目