题目内容
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为___________________________________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
结合实验目的和表中数据,你得出的结论是__________________________________。
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请根据以下实验设计表将实验目的补充完整:
(1)该反应的离子方程式为___________________________________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
| A.反应放热导致温度升高 | B.压强增大 |
| C.生成物的催化作用 | D.反应物接触面积增大 |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请根据以下实验设计表将实验目的补充完整:
| 实验 编号 | 铜片 质量/g | 0.1mol·L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 实验①和②探究 的影响;实验①和③探究 的影响。 |
| ② | 5 | 20 | 0.5 | 0 | |
| ③ | 5 | 20 | 0 | 0.5 |
(10分)(1)3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O (2分) (2)AC(2分)
(3)温度不是反应速率明显加快的主要原因。(2分)(4) Cu2+(2分) 亚硝酸根(2分)
(3)温度不是反应速率明显加快的主要原因。(2分)(4) Cu2+(2分) 亚硝酸根(2分)
试题分析:(1)稀硝酸是氧化性酸,和铜反应生成硝酸铜、NO和水,则该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(2)反应物都不是气态,则压强对反应速率没有影响。随着反应的进行,反应物接触面积应该逐渐减小,所以引起反应速率增大的原因可能是反应放热导致温度升高或生成物的催化作用,因此答案选AC。
(3)根据表中数据可知,反应过程中溶液的温度变化不大,这说明温度不是反应速率明显加快的主要原因。
(4)根据表中数据可知,实验①和②中不同之处在于是否加入了硝酸铜,所以实验①和②探究的是铜离子对反应速率的影响;同样分析可知,实验①和③中不同之处在于是否加入了亚硝酸钠,所以实验①和③探究的是亚硝酸根对反应速率的影响。
点评:该题是中等难度的试题,侧重对学生实验能力的培养,有利于调动学生学习兴趣,激发学生的学习积极性,也有利于培养学生规范严谨的实验设计能力,提升学生的学科素养。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 CO2(g)+H2(g)
CO2(g)+H2(g)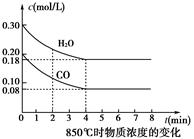
 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,c(A)︰c(B)=3:5,C的平均反应速率是0.1m0L/(L·min)
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,c(A)︰c(B)=3:5,C的平均反应速率是0.1m0L/(L·min)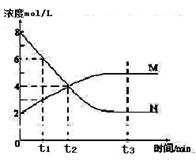
 2NH3,根据下列在相同时间内测得的结果判断,生成氨的反应速度最快的是:
2NH3,根据下列在相同时间内测得的结果判断,生成氨的反应速度最快的是:  2SO3(g)
2SO3(g)