题目内容
常温下,向含2 mol NaClO的稀溶液中通入1 mol CO2二氧化碳,充分反应后,生成1 mol HClO和1 mol NaHCO3,
经检验溶液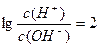 .有关反应后该混合溶液的叙述正确的是
.有关反应后该混合溶液的叙述正确的是
经检验溶液
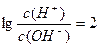 .有关反应后该混合溶液的叙述正确的是
.有关反应后该混合溶液的叙述正确的是| A.上述反应对应的离子方程式为2ClO-+CO2+H2O=2HClO+CO32- |
| B.上述溶液中:c(ClO-)>c(HCO3-)>c(CO32-) |
| C.上述溶液中:c(ClO-)+c(HClO)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.上述溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(ClO-) |
B
从题干信息可看出,电离H+能力:H2CO3>HClO>HCO3-,离子方程式为ClO-+CO2+H2O=HClO+HCO3-,A选项错误;反应后的溶液中含有1 mol NaClO、1mol HClO、1mol NaHCO3,由
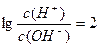
得c(H+)=1×10-6 mol·L-1,溶液呈酸性,说明次氯酸电离程度大于次氯酸钠、碳酸氢钠水解能力,故有c(ClO-)>c(HCO3-),而HCO3-电离程度很小,则有c(HCO3-)>c(CO32-),B选项正确;氯的物质的量是碳的物质的量2倍,该溶液的物料守恒式有:c(ClO-)+c(HClO)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),C选项错误;该溶液的电荷守恒式为c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(ClO-)+2c(CO32-),D选项错误。

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目

 、NO
、NO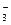
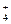 、K+、Cl-、NO
、K+、Cl-、NO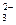
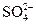
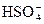
 2HI(g),达到平衡时,下列有关说法不正确的是
2HI(g),达到平衡时,下列有关说法不正确的是