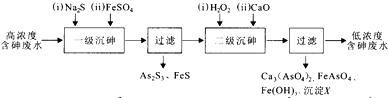
题目内容
【题目】工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
(1)写出①步反应的化学方程式: .
(2)下列环境问题与NO2的排放有关的是(填字母序号).
A.赤潮
B.光化学烟雾
C.臭氧空洞
D.温室效应
E.酸雨
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标准状况),则所消耗的硝酸的物质的量是 . 
【答案】
(1)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(2)BE
(3)0.65mol
【解析】解:(1)反应①是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2 ![]() 4NO+6H2O,
4NO+6H2O,
所以答案是:4NH3+5O2 ![]() 4NO+6H2O;(2)A.造成赤潮的物质是N、P化合物,故A错误;
4NO+6H2O;(2)A.造成赤潮的物质是N、P化合物,故A错误;
B.光化学烟雾,是城市大气中的碳氢化合物(HC)和氮氧化合物(NOx)在阳光紫外线的作用下发生的一系列链式大气化学反应生成以臭氧(O3)为代表的刺激性二次污染物,与NO2有关,故B正确;
C.引起臭氧空洞的主要原因是一种叫“氟利昂”的物质破坏了平流层大气中的臭氧,故C错误;
D.造成温室效应的气体是二氧化碳,而不是二氧化氮,故D错误;
E、酸雨是因为二氧化硫、氮氧化物的排放,以及一些工业气体的排放,与二氧化氮的排放有关,故E正确;
所以答案是:BE;(3)12.8gCu的物质的量= ![]() =0.2mol,气体的物质的量=
=0.2mol,气体的物质的量= ![]() =0.25mol,
=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol,
所以答案是:0.65mol.

练习册系列答案
相关题目