题目内容
下列实验操作与实验目的相符的是( )
|
分析:A.熔沸点属于物理性质,非金属性强弱属于化学性质;
B.复分解反应不能用以比较非金属性强弱;
C.比较非金属性应是最高价氧化物对应的水化物;
D.向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量,如先生成沉淀说明氨水的碱性比氢氧化铝强,否则相反.
B.复分解反应不能用以比较非金属性强弱;
C.比较非金属性应是最高价氧化物对应的水化物;
D.向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量,如先生成沉淀说明氨水的碱性比氢氧化铝强,否则相反.
解答:解:A.HF、HCl的熔点、沸点属于物理性质,非金属性强弱属于化学性质,不能用物理性质来比较化学性质,故A错误;
B.MgSO4、Al2(SO4)3溶液中分别滴加足量氨水都生成沉淀,属于复分解反应,不能用来比较非金属性强弱,故B错误;
C.SO2气体通入碳酸钠溶液中先生成H2SO3,H2SO3的酸性比碳酸强,但比较非金属性应是最高价氧化物对应的水化物,故C错误;
D.向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量,符合强碱制取弱碱规律,NaOH碱性最强,如先生成沉淀说明氨水的碱性比氢氧化铝强,否则相反.故D正确.
故选D.
B.MgSO4、Al2(SO4)3溶液中分别滴加足量氨水都生成沉淀,属于复分解反应,不能用来比较非金属性强弱,故B错误;
C.SO2气体通入碳酸钠溶液中先生成H2SO3,H2SO3的酸性比碳酸强,但比较非金属性应是最高价氧化物对应的水化物,故C错误;
D.向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量,符合强碱制取弱碱规律,NaOH碱性最强,如先生成沉淀说明氨水的碱性比氢氧化铝强,否则相反.故D正确.
故选D.
点评:本题考查非金属性、金属性的实验设计,题目易错点为C,注意比较非金属性应是最高价氧化物对应的水化物.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示: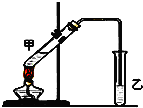 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:



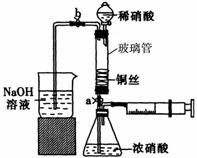 Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。