题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2L气体(标准状况下)
②常温常压下,16gO2和16gO3含氧原子数均为NA
③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA
④6.5g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1 Na
⑤106gNa2CO3粉末中含有CO32-数为NA
| A.②④⑤ | B.①③⑤ | C.①②④⑤ | D.①②③ |
A
解析试题解析:用Cu作电极电解饱和食盐水,Cu是活泼电极,阳极电极失电子,不会产生气体,①错;O2、O3均由O原子构成,16g O2、O3含有的O原子数均为NA,②正确;乙醇标准状况下是液体,无法用气体摩尔体积计算,③错;Zn与浓硫酸反应时,会生成SO2气体,若浓硫酸变稀,还会发生Zn与稀硫酸的反应,生成H2,无论哪个反应,根据方程式可知,转移电子数为2mol时,生成气体1mol,6.5g Zn的物质的量为0.1mol,反应失去电子0.2mol,则生成的气体分子数为0.1mol,④正确;Na2CO3晶体属于离子晶体,每个分子由2个Na+和1个CO32-构成,106g Na2CO3粉末的物质的量为1mol,则含有CO32-数为NA,⑤正确。
考点:考查阿伏伽德罗常数。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.45gHCHO与CH3COOH混合物含氢原子数为3NA |
| B.常温常压下,54g重水(D2O)含水分子数为3NA |
| C.标准状况下,11.2L苯含有C-H键数目为3NA |
| D.反应KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2转移电子数为3NA |
下列有关化学用语表示正确的是
| A.Mg2+的电子排布式:1s22s22p63s2 |
B.铁的原子结构示意图: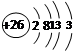 |
C.Na2S的电子式: 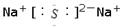 |
| D.次氯酸的结构式:H-Cl-O |
下列说法不正确的是(设NA为阿伏加德罗常数的数值)( )
| A.20g重水含有10NA个电子 |
| B.1L 0.1 mol·L-1 Na2SO3溶液中含有的SO32-数目少于0.1NA个 |
| C.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高 |
| D.用足量铜粉除去FeCl2溶液中的FeCl3杂质 |
用NA表示阿伏加德罗常数,下列说法中正确的有
| A.lmol Na2O2晶体中共含有4NA个离子 |
| B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C.常温常压下16gO2和O3混合气体含有NA个氧原子 |
| D.1mol?L-1的CaCl2溶液中含Cl-的数目为2NA; |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA |
| B.1 mol乙烷分子含有8NA个共价键 |
| C.58.5 g的氯化钠固体中含有NA个氯化钠分子 |
| D.在0.1 mol过氧化钠固体中,阴离子总数等于0.1 NA |
下列说法正确的是( )
| A.摩尔是七个基本物理量之一 |
| B.1mol氢 |
| C.摩尔是表示物质的数量单位 |
| D.每摩尔物质都含有阿伏加德罗常数个指定微粒 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.46 g乙醇中含有的化学键数为7 NA |
| B.1 mol氯气和足量NaOH溶液反应转移电子数为2 NA |
| C.1 mol OH-和1 mol -OH(羟基)中含有的质子数均为 9 NA |
| D.10 L 0.1 mol·L-1的Na2CO3溶液中,Na+、CO32-总数为3 NA |
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为 mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)= mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是 (填序号)。
| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 |
| D.需要称量NaClO固体的质量为143.0 g |

(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为 mol·L-1。
②需用浓硫酸的体积为 mL。