题目内容
在化学研究中,溶液组分的表示还有两种方法:①质量摩尔浓度=溶质的物质的量/1 kg溶剂;②摩尔分数=溶质的物质的量/(溶质的物质的量+溶剂的物质的量)。在某温度范围内,溶液的物态不发生变化(没有溶质析出,也没有溶剂挥发)。下列溶液组分的表示方法中受温度影响的是( )A.物质的量浓度 B.质量分数
C.质量摩尔浓度 D.物质的量分数
A
解析:温度发生变化,溶液的体积也要发生变化,质量、物质的量等均不随温度的变化而变化。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案①写出该反应的化学方程式:___________________________________________________;
②上述反应中生成0.1 mol还原产物时,转移电子的物质的量是_________________mol;
③由单质与氧气反应生成
(2)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4![]() Na2SO4+S↓+SO2↑+H2O)。
Na2SO4+S↓+SO2↑+H2O)。
烧杯编号 | 加3%Na2S2O3溶液体积(mL) | 加H2O体积(mL) | 加(体积比为1∶20)H2SO4溶液体积(mL) | 所需时间(s) |
1 | 5 | 5 | 2 |
|
2 | 7 | 3 | 2 |
|
3 | 10 | 0 | 2 |
|
在三个烧杯(底部有黑色“+”字标记)内分别加入表中所示体积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“+”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是_________________,因变量是_________________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:
__________________________________。
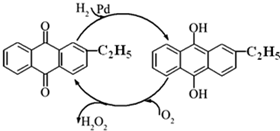 过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验. I2+O2+H2O
I2+O2+H2O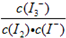
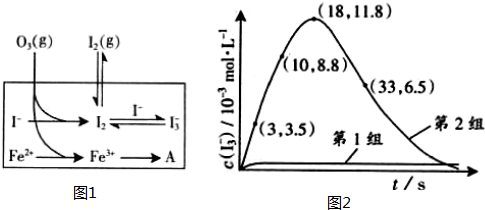
 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高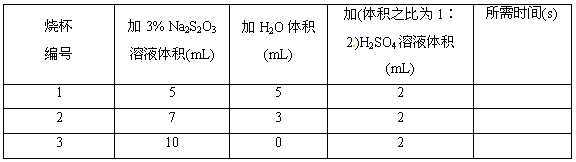
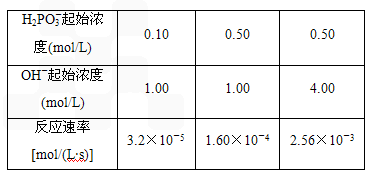
 HPO32-+ H2O 反应结果如下表所示
HPO32-+ H2O 反应结果如下表所示 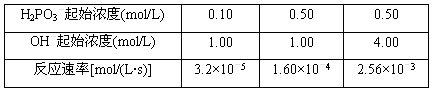
 Na2SO4+S↓+SO2↑+H2O) 为0.20 mol/L, c(OH-)的起始浓度为1.50 mol/L,则反应速率v=____________.
Na2SO4+S↓+SO2↑+H2O) 为0.20 mol/L, c(OH-)的起始浓度为1.50 mol/L,则反应速率v=____________. 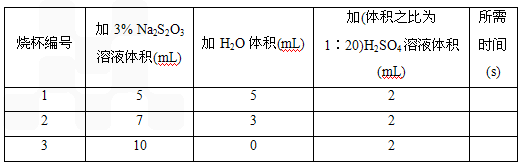
 HPO32-+H2O 反应结果如下表所示:
HPO32-+H2O 反应结果如下表所示: