题目内容
【题目】常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
序号 | a | b | c | d | e | f |
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为________。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是________________(用离子方程式表示)。
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有__(填字母代号)。
A.pH=8. 8的NaOH溶液
B.pH=5. 2的NH4Cl溶液
C.pH=5. 2的盐酸
D.0. 1 mol/L的NaCN溶液
E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有_____。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B.2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C.c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D.c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为__________。
【答案】CH3COO-AlO-+2H2O![]() Al(OH)3+OH-BEBDEc(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
Al(OH)3+OH-BEBDEc(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
【解析】
(1)弱酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小,则酸根离子结合质子能力越小;
(2)NaAlO2为强碱弱酸盐,水解呈碱性;
(3)酸或碱抑制了水的电离,含有弱离子的盐促进水电离,据此对各选项进行判断;
(4)任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
(5)0.2mol/LHCl与0.1mol/L NaAlO2溶液等体积混合,设体积都为1L,反应后生成Al(OH)3和Al3+。
(1)相同浓度的钠盐溶液,pH越小则盐的水解程度越小,阴离子结合H+能力最弱的就是弱酸根对应的酸酸性最强的。酸性强弱CH3COOH>H2CO3>HClO>HCN>HAlO2,所以阴离子结合H+能力最弱的为CH3COO-,
因此,本题正确答案为:CH3COO-;
(2)NaAlO2是强碱弱酸盐,AlO-水解使溶液显碱性,AlO-+2H2O![]() Al(OH)3+OH-,
Al(OH)3+OH-,
因此,本题正确答案为:AlO-+2H2O![]() Al(OH)3+OH-;
Al(OH)3+OH-;
(3)0.1mol/L的CH3OONa溶液,促进水的电离,水电离的c(OH-)=![]() =10-5.2mol/L,
=10-5.2mol/L,
A.pH=8.8的NaOH溶液,抑制水的电离,水电离的c(H+)=10-8.8mol/L,不符合题意;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离的c(H+)=10-5.2mol/L,符合题意;
C.pH=5.2的盐酸,抑制水的电离,水电离的c(OH-)=![]() =10-8.8mol/L,不符合题意;
=10-8.8mol/L,不符合题意;
D.0.1mol/L的NaCN溶液,促进水的电离,水电离的c(H+)=10-11.1mol/L,不符合题意;
E.pH=8.8的Na2CO3溶液,促进水的电离,水电离的c(OH-)=![]() =10-5.2mol/L,符合题意;
=10-5.2mol/L,符合题意;
所以与0.1mol/L的CH3OONa溶液中水的电离程度相同的是:BE,
因此,本题正确答案为:BE;
(4)将浓度均为0. 1 mol/L的NaHCO3、Na2CO3等体积混合,混合溶液中粒子之间符合电荷守恒,物料守恒和质子守恒。NaHCO3溶液有物料守恒:c(Na+)=c(CO32-) +c(HCO3-) +c(H2CO3);Na2CO3溶液有c(Na+)=2 c(CO32-) +2 c(HCO3-) +2 c(H2CO3);二式相加即2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3);B正确。电荷守恒c(Na+) +c(H+) = 2 c(CO32-) + c(HCO3-) +c(OH-)D正确;
CO32-)水解程度大于HCO3-,溶液呈碱性,所以有c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+),E正确。
(5)0.2mol/LHCl与0.1mol/L NaAlO2溶液等体积混合,设体积都为1L,反应后生成Al(OH)3和Al3+,其中Al3+为![]() mol,Al3+水解呈酸性,离子浓度大小顺序为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),
mol,Al3+水解呈酸性,离子浓度大小顺序为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),
因此,本题正确答案为:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)。

 阅读快车系列答案
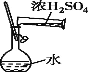
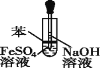
阅读快车系列答案【题目】下列实验方案合理的是( )
|
|
|
|
A.制取少量CO2,可随开随制,随关随停 | B.配制一定物质的量浓度的稀硫酸 | C.可制得Fe(OH)2,并观察其颜色 | D. 干燥、收集NH3,并吸收多余的尾气 |
A. AB. BC. CD. D