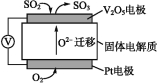
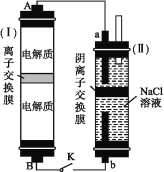
题目内容
【题目】填空题
(1)浓H2SO4能够用于干燥某些气体,是由于它具有性;下列气体能用浓硫酸来进行干燥的是(可多选,但只要有选错项,即得0分) ①Cl2②H2S ③CO2④NH3
(2)浓H2SO4能使纸片变黑,是由于它具有性;
(3)浓H2SO4可以与Cu反应,是由于它具有强氧化性和性,化学学方程式是: .
【答案】
(1)吸水;①③
(2)脱水
(3)酸;Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】解:(1)浓H2SO4具有吸水性能够用于干燥某些气体,但浓硫酸又有强氧化性和酸性,则H2S具有强还原性,NH3具有碱性不能用浓硫酸干燥,所以答案是:吸水;①③;(2)浓H2SO4具有脱水性使纸片炭化变黑,所以答案是:脱水;(3)浓H2SO4可以与Cu反应生成硫酸铜、二氧化硫和水,方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,体现了浓硫酸的强氧化性和酸性,所以答案是:酸;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,体现了浓硫酸的强氧化性和酸性,所以答案是:酸;Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O.
CuSO4+SO2↑+2H2O.

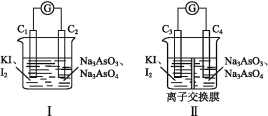
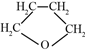
【题目】用乙醇与浓硫酸的混合液在加热的条件下可以发生消去反应,某实验小组的同学在实验室用如下图所示装置验证消去反应的产物。(气密性已检验,部分夹持装置略)。

实验操作和选项:
操作 | 现象 |
点燃酒精灯加热至 | Ⅰ: Ⅱ: |
…… | |
实验完毕,清洗烧瓶 | Ⅲ: |
(1)烧瓶内发生的有机反应化学方程式是____________________________________,烧瓶内产生刺激性气味的气体的无机反应化学方程式是____________________________________。
(2)溶液“渐渐变黑”说明浓硫酸具有_________性。
(3)甲同学认为若![]() 中溶液褪色,即可证明烧瓶中发生了消去反应,根据甲同学的观点,使
中溶液褪色,即可证明烧瓶中发生了消去反应,根据甲同学的观点,使![]() 中溶液褪色反应的化学方程式是____________________________________。
中溶液褪色反应的化学方程式是____________________________________。
(4)乙同学却认为即使![]() 中溶液褪色,也不能证明烧瓶中发生了消去反应。于是提出了两种改进方案①在
中溶液褪色,也不能证明烧瓶中发生了消去反应。于是提出了两种改进方案①在![]() 、
、![]() 间增加一个装有某种试剂的洗气瓶,该试剂为___________________________________。
间增加一个装有某种试剂的洗气瓶,该试剂为___________________________________。
②在![]() 、
、![]() 间增加一个盛有浓硫酸的洗气瓶,并将
间增加一个盛有浓硫酸的洗气瓶,并将![]() 中的
中的![]() 的水溶液改为
的水溶液改为![]() 的
的![]() 溶液,即可排除干扰,据实验现象可证明烧瓶中发生了消去反应。
溶液,即可排除干扰,据实验现象可证明烧瓶中发生了消去反应。
则乙同学认为![]() 中使
中使![]() 的水溶液褪色,产生干扰的原因(用化学方程式解释)_________,由方案②可知___________ 不能使
的水溶液褪色,产生干扰的原因(用化学方程式解释)_________,由方案②可知___________ 不能使![]() 的四氯化碳溶液褪色。
的四氯化碳溶液褪色。