题目内容
20.下列说法不正确的是( )| A. | 4.5g SiO2晶体中含有的硅氧键的数目为0.3NA | |
| B. | 向FeI2溶液中通入适量C12,当有1mol1Fe2+被氧化时,共转移的电子的数目为3NA | |
| C. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| D. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
分析 A.1molSiO2中含Si-O键的个数为4NA;
B.碘离子和亚铁离子都能够被氯气氧化且先氧化碘离子再氧化亚铁离子;
C.一个六元碳环中含有1×$\frac{1}{3}$×6=2个C结合石墨的物质的量计算;
D.铁与稀硝酸的反应中,反应产物可能为硝酸亚铁或硝酸铁.
解答 解:A.4.5gSiO2晶体物质的量为0.075mol,含Si-O键的物质的量=0.075mol×4=0.3mol,即0.3NA,故A正确;
B.FeI2溶液中,碘离子的还原性大于亚铁离子的,通入适量氯气,当有1molFe2+被氧化时,溶液中碘离子已经完全被氧化,由于不知道碘化亚铁的物质的量,无法计算转移的电子数,故B错误;
C.12g单层石墨的物质的量为1mol,一个六元碳环中含有1×$\frac{1}{3}$×6=2个,所以12g单层石墨中含有六元环的个数为0.5NA,故C正确;
D.5.6g铁的物质的量为0.1mol,0.1mol铁与硝酸反应,如果硝酸不足,反应生成0.1mol亚铁离子,失去0.2mol电子,失去的电子为0.2NA,故D错误;
故选:BD.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意根据原子晶体的结构分析晶体中含有的化学键数目,注意离子还原性强弱,题目难度中等.

练习册系列答案
相关题目
10.下列变化中,涉及不到化学变化的是( )
| A. | 石油的分馏 | B. | 氯气溶于水 | C. | 食物腐败 | D. | 煤的干馏 |
11.下列溶液中,氯离子的物质的量浓度与50mL 1mol•L-1氯化铝溶液中氯离子的物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 1.5 mol•L-1氯化钾溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
15.下列各组离子在溶液中一定能大量共存的是( )
| A. | Na+、Ba2+、Cl-、NO3- | |
| B. | Pb2+、Hg2+、S2-、SO42- | |
| C. | 0.1mol/L的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| D. | 0.1mol/L Na2CO3的溶液中:K+、Ba2+、NO3-、Cl- |
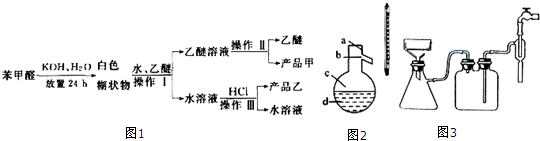
8. 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验步骤:
1、[合成]:在a中加入适量纯环己醇及2小块沸石,冷却搅动下缓慢加入1 mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的有机副产物的结构简式为 .
.
(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4加入无水CaCl2的作用是干燥所得环己烯.
 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
1、[合成]:在a中加入适量纯环己醇及2小块沸石,冷却搅动下缓慢加入1 mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的有机副产物的结构简式为
 .
.(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4加入无水CaCl2的作用是干燥所得环己烯.
9.下列说法不正确的是( )
| A. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧贴烧杯内壁 | |
| B. | 分液时,下层液体应从分液漏斗下口放出,上层液体从上口倒出 | |
| C. | 蒸馏时,在蒸馏烧瓶中盛约 $\frac{1}{3}$体积的液体,并放入几粒沸石,将温度计水银球插入液体中,冷水从冷凝管下口进,上口出,收集时,应弃去开始馏出的部分液体 | |
| D. | 加热蒸发氯化钠溶液时,加热到有大量晶体析出时即停止加热,不能加热到全部蒸干 |

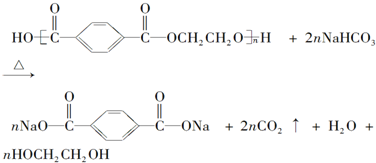
 已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题: