题目内容
某化学反应的反应物和产物如下:
(1)配平该氧化还原反应
KMnO4+ HCl(浓)═ KCl+ Cl2↑+ MnCl2+ H2O
(2)该反应的氧化剂是 .
(3)该反应的氧化产物是 .
(4)反应过程中转移5mol e-,生成标准状况下Cl2的体积为 L.
(5)HCl表现出 性和 性.
(1)配平该氧化还原反应
(2)该反应的氧化剂是
(3)该反应的氧化产物是
(4)反应过程中转移5mol e-,生成标准状况下Cl2的体积为
(5)HCl表现出
考点:氧化还原反应,氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)反应中KMnO4+→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数;
(2)根据化合价的变化判断;
(3)还原剂被氧化后的产物为氧化产物;
(4)只有氯气是氧化产物,根据电子转移守恒计算生成的氯气的物质的量,再根据V=nVm计算氯气的体积;被氧化的氯化氢生成氯气,根据氯原子守恒可知被氧化的氯化氢是氯气的2倍;
(5)产物中氯元素存在于KCl、MnCl2、Cl2中,KCl、MnCl2中Cl元素化合价与HCl的Cl元素化合价相同为-1价,HCl表现酸性,氯气中Cl元素化合价为0价,HCl表现还原性.
(2)根据化合价的变化判断;
(3)还原剂被氧化后的产物为氧化产物;
(4)只有氯气是氧化产物,根据电子转移守恒计算生成的氯气的物质的量,再根据V=nVm计算氯气的体积;被氧化的氯化氢生成氯气,根据氯原子守恒可知被氧化的氯化氢是氯气的2倍;
(5)产物中氯元素存在于KCl、MnCl2、Cl2中,KCl、MnCl2中Cl元素化合价与HCl的Cl元素化合价相同为-1价,HCl表现酸性,氯气中Cl元素化合价为0价,HCl表现还原性.
解答:
解:(1)反应中KMnO4+→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2;16;2;5;2;8;
(2)KMnO4中Mn元素的化合价降低,作氧化剂;
故答案为:KMnO4;
(3)反应中HCl被高锰酸钾氧化为氯气,所以Cl2是氧化产物;
故答案为:Cl2;
(4)只有氯气是氧化产物,生成1mol氯气转移2mol电子,根据电子转移守恒可知生成的氯气的物质的量为
=2.5mol,故氯气的体积为2.5mol×22.4L/mol=56L;
故答案为:56;
(5)产物中氯元素存在于KCl、MnCl2、Cl2中,KCl、MnCl2中Cl元素化合价与HCl的Cl元素化合价相同为-1价,HCl表现酸性,氯气中Cl元素化合价为0价,HCl表现还原性,反应中HCl体现酸性、还原性,
故答案为:酸、还原.
故答案为:2;16;2;5;2;8;
(2)KMnO4中Mn元素的化合价降低,作氧化剂;
故答案为:KMnO4;
(3)反应中HCl被高锰酸钾氧化为氯气,所以Cl2是氧化产物;
故答案为:Cl2;
(4)只有氯气是氧化产物,生成1mol氯气转移2mol电子,根据电子转移守恒可知生成的氯气的物质的量为
| 5mol |
| 2 |
故答案为:56;
(5)产物中氯元素存在于KCl、MnCl2、Cl2中,KCl、MnCl2中Cl元素化合价与HCl的Cl元素化合价相同为-1价,HCl表现酸性,氯气中Cl元素化合价为0价,HCl表现还原性,反应中HCl体现酸性、还原性,
故答案为:酸、还原.
点评:本题考查氧化还原反应配平、计算及基本概念等,难度不大,注意掌握常用氧化还原反应的配平方法.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①澄清石灰水中通过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸.
①澄清石灰水中通过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸.
| A、②④ | B、③④ | C、④ | D、①③ |
在一定温度下,一恒容容器中发生反应2A2(g)+B2(g)?2AB(g),该反应达到平衡状态的标志是( )
| A、单位时间生成n mol的A2同时生成n mol的AB |
| B、容器内的总压强不随时间变化 |
| C、容器内的气体密度不随时间变化 |
| D、单位时间内生成n mol的A2同时生成n mol的B2 |
 M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如图所示,则:
M元素的单质可用于原子反应堆的导热剂,其原子结构示意图如图所示,则:
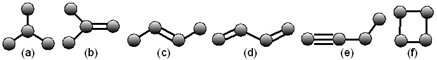
 维生素A对人体特别是对人的视力有重要作用,其结构简式如图:
维生素A对人体特别是对人的视力有重要作用,其结构简式如图: