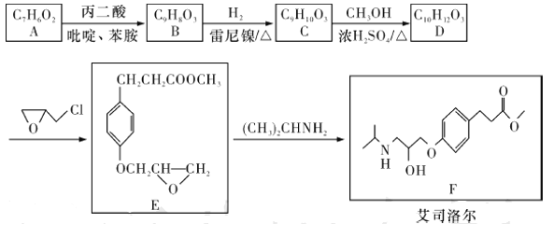
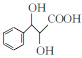
题目内容
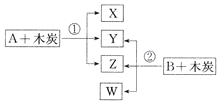
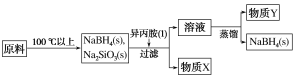
【题目】硼氢化钠(NaBH4)在有机合成中被称为“万能还原剂”,它的特点是性能稳定,还原时有选择性。采用NaBO2、SiO2、Na、H2为原料制备NaBH4的流程如图所示。
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33 ℃)。
(1)NaBH4中含有的化学键类型为____________________。
(2)制取NaBH4的化学方程式为_________________________________________________;
在该反应加料之前,需要将反应容器加热至100 ℃以上并通入氩气,通入氩气的目的是__ 。
(3)在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为_______ 。
(4)物质X的化学式为__________;以上流程中可以循环使用的物质是_________。
【答案】离子键、共价键 ![]() 排出反应器中的水蒸气和空气 8Au3++3BH4+24OH=8Au+3BO2+18H2O Na2SiO3 异丙胺
排出反应器中的水蒸气和空气 8Au3++3BH4+24OH=8Au+3BO2+18H2O Na2SiO3 异丙胺
【解析】
NaBO2、二氧化硅、钠和氢气加热到100℃以上生成了硼氢化钠,同时生成硅酸钠。加入异丙胺,硼氢化钠溶于异丙胺,进入到溶液中,硅酸钠不溶于异丙胺,过滤出来,即是物质X。将溶液蒸馏,把异丙胺蒸馏出去,剩下的固体即为硼氢化钠。
(1)在硼氢化钠中存在着钠离子和硼氢根离子,两种离子之间是离子键,BH4-中B和H之间是共价键。故答案为:离子键、共价键;
(2)NaBO2、二氧化硅、钠和氢气加热到100℃以上生成了硼氢化钠,同时生成硅酸钠。因为硼氢化钠能跟水发生反应且有很强的还原性,所以通入氩气,排除反应器中的水蒸汽和空气。故答案为:![]() ,排出反应器中的水蒸气和空气;
,排出反应器中的水蒸气和空气;
(3)硼氢化钠中氢是负一价,体现出很强的还原剂,把Au3+还原成单质,氢本身化合价升高,由于无气体生成,所以氢变成正一价,再根据溶液是强碱性,写出离子方程式:8Au3++3BH4+24OH=8Au↓+3BO2+18H2O;
(4)第一步反应生成硼氢化钠的同时还生成硅酸钠,硼氢化钠溶于异丙胺,而硅酸钠不溶,过滤后物质X是硅酸钠。流程最后蒸馏出去的异丙胺可以循环使用。故答案为:Na2SiO3,异丙胺。

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
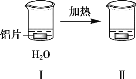
三新快车金牌周周练系列答案【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的