题目内容
【题目】有关![]() 的说法正确的是
的说法正确的是
A.所有碳原子不可能都在同一平面上
B.最多只可能有9个碳原子在同一平面上
C.有7个碳原子可能在同一直线上
D.只可能有5个碳原子在同一直线上
【答案】D
【解析】
试题分析:![]() 中含有碳碳三键、双键和苯环,苯环中的所有原子均处于同一平面内,碳碳三键中两个碳在一直线上,且取代的是苯环中H的位置,所以与苯环在同一平面内,碳碳双键取代的是苯环中H的位置,其中两个碳和两个H与苯环在同一平面内,且甲基是取代的乙烯中H的位置,也可以有一个C和H 与苯环共平面;A.依据此分析,可知所有原子可以共平面,故A错误;B.所有碳原子可以共平面,共11个,故B错误;C.碳碳三键、双键上1个碳与苯环上的2个碳可以共直线,故C错误;D.碳碳三键、双键上一个碳与苯环上的2个碳可以共直线,故D正确,故选D。
中含有碳碳三键、双键和苯环,苯环中的所有原子均处于同一平面内,碳碳三键中两个碳在一直线上,且取代的是苯环中H的位置,所以与苯环在同一平面内,碳碳双键取代的是苯环中H的位置,其中两个碳和两个H与苯环在同一平面内,且甲基是取代的乙烯中H的位置,也可以有一个C和H 与苯环共平面;A.依据此分析,可知所有原子可以共平面,故A错误;B.所有碳原子可以共平面,共11个,故B错误;C.碳碳三键、双键上1个碳与苯环上的2个碳可以共直线,故C错误;D.碳碳三键、双键上一个碳与苯环上的2个碳可以共直线,故D正确,故选D。

 名校课堂系列答案
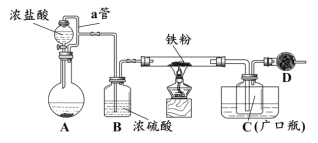
名校课堂系列答案【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:

步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
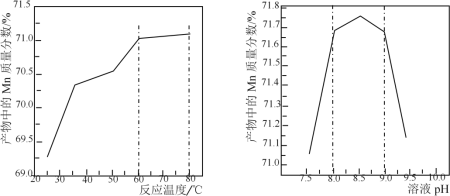
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+2B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、2molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是( )
A.v甲=v丙B.c乙<c丙C.a甲 +a乙<1D.K乙
【题目】按要求填空:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是___,第一电离能最小的元素的电子排布图为___。
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
①![]() ②
②![]() ③
③ ![]() ④
④![]() ⑤
⑤ ![]() ⑥
⑥ ![]()
违反泡利不相容原理的有__,违反洪特规则的有___。
(3)用VSEPR模型和杂化轨道理论相关知识填表:
分子或离子 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | 分子有无极性 |
CH2O | ________ | _______ | _____ |
NH4+ | ________ | _______ | _____ |
CS2 | ________ | _______ | _____ |