题目内容
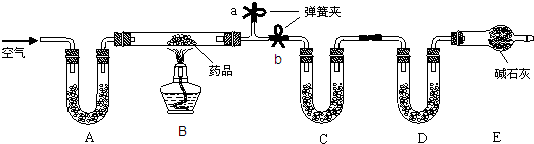
(14分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
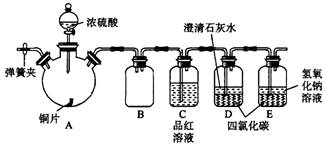
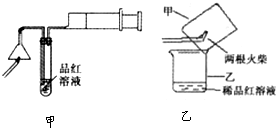
实验选用铜片、98.3%的H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜片一端没入浓H2SO4中,另一端露置在液面上方。
回答下列问题。
(1)Cu与浓H2SO4的反应的化学方程式为____________________。
(2)D、E两容器中CCl4的作用是____________________。
(3)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,A容器下有白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是_________________________________________,设计实验验证你的猜想_______________________________________。
(5)实验结束后,为了减少环境污染,排除各装置中的SO2,可采取的操作是________________________________________________________。
(1) Cu+2H2SO4(浓) CuSO4+SO2↑+H2O(2分) (2) 防止倒吸(2分)
CuSO4+SO2↑+H2O(2分) (2) 防止倒吸(2分)
(3)CuSO4 (2分), 浓硫酸中含水少,生成的硫酸铜较多,浓硫酸的吸水作用(2分)
(4)由于SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,生成了Ca(HSO3)2溶液的缘故(2分);取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(2分)(或者加热、加盐酸检验SO2气体等方法)
(5)打开A容器上的弹簧夹,向里通入空气,将装置中的SO2赶到E中,最后再在B中加入NaOH溶液盖上塞子,振荡即可(2分)(注:直接在A中加NaOH溶液不给分)
【解析】(1)浓硫酸具有强氧化性,和铜的反应的方程式是Cu+2H2SO4(浓) CuSO4+SO2↑+H2O。
CuSO4+SO2↑+H2O。
(2)由于SO2易溶于水,如果直接通入SO2,容易引起倒吸。而SO2不溶于四氯化碳,且四氯化碳不溶于水,密度大于水,所以四氯化碳的作用就是防止倒吸。
(3)由于浓硫酸中含有的溶剂水很少,而生成的硫酸铜较多,且浓硫酸具有吸水性,所以会有硫酸铜晶体析出。
(4)由于SO2溶解度较大,澄清石灰水中Ca(OH)2含量低,因此SO2是过量的,所以不能生成硫酸钙沉淀,而是生成了可溶性的Ca(HSO3)2,因此溶于不变混浊。由于Ca(HSO3)2能和强碱反应生成沉淀,据此可以鉴别。或者利用Ca(HSO3)2和盐酸反应生成SO2来检验。即取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成(或者加热、加盐酸检验SO2气体等方法)。
(5)由于装置中会残留没有挥发出的SO2,所以正确的做法是打开A容器上的弹簧夹,向里通入空气,将装置中的SO2赶到E中,最后再在B中加入NaOH溶液盖上塞子,振荡即可。

 名校课堂系列答案
名校课堂系列答案| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 35℃以上分解 | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| A、第一、二步反应的基本类型为化合反应、分解反应 |
| B、第一、二步反应之间的主要实验操作是过滤、洗涤 |
| C、第一步反应控制温度高于30℃目的是提高反应产率 |
| D、反应液加盐酸处理可使NaCl循环使用并回收NH4Cl |
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.