题目内容
12.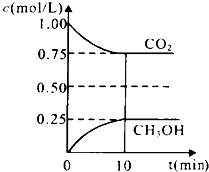 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.(1)能说明该反应已达平衡状态的是AB.(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
(2)计算该温度下此反应的平衡常数K=0.20.(保留两位有效数字).若改变条件C(填选项),可使K=1.
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(3)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子浓度由大到小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析 (1)平衡状态的标志可以两个方两去判断,一、是看正逆反应速是否相等,二是各组分的浓度和分数是否随时间的改变而改变;也可以抓住未平衡时是个变量,现在不变说明已经达到平衡状态了,来解决问题;
(2)用三行式来求平衡时的各组分浓度,然后代入平衡常数表达式求解,要注意代入平衡常数表达式是平衡浓度,平衡常数是温度的函数,温度变平衡常数才变,到底如何变,还要看反应的热效应;
(3)2.4g碳是0.2mol,燃烧生成0.2molCO2,与0.3molNaOH反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3+H2O,生成0.1molNa2CO3、0.1molNaHCO3,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,碳酸根离子水解大于碳酸氢根离子的水解,水解使溶液显碱性,以此来解答.
解答 解:(1)未平衡时是个变量,现在不变说明已经达到平衡状态了,
A.未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故A正确;
B.未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故C错误;
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故D错误;
故选AB;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=$\frac{0.25×0.25}{0.75×0.75{\;}^{3}}$=0.20,
而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,变化为1,
故答案为:0.20;C;
(3)2.4g碳是0.2mol,燃烧生成0.2molCO2,与100mL 3.0mol/L即含有0.3molNaOH反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3+H2O,生成0.1molNa2CO3、0.1molNaHCO3,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO3-)>c(CO32-),水解使溶液显碱性,则c(OH-)>c(H+),显性离子大于隐性离子,所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),即离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查平衡状态的判断、化学平衡的计算、离子浓度大小比较,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,比较离子浓度大小时应掌握溶液的成分,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 2mol/L的H2SO4溶液 | B. | 2mol/L的NaOH溶液 | ||
| C. | 2mol/L的MgSO4溶液 | D. | 硅酸溶胶 |
| A. | 小于7 | B. | 小于5.6 | C. | 大于5.6 | D. | 小于0 |
 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.