题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.2mol丁烷完全裂解生成乙烯的分子数一定为0.2NA
B.13gNaN3爆炸分解为Na和N2 , 转移电子数为0.2NA
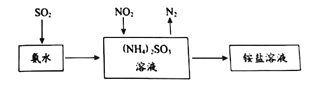
C.1L0.1mol·L-1(NH4)2SO3溶液中,含NH4+数目为0.2NA
D.0.2molN2O4充入密闭容器中,产生气体分子总数为0.4NA
【答案】B
【解析】
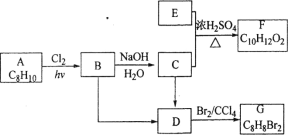
A.丁烷裂解过程中可能发生的反应为:C4H10→C2H4+C2H C4H10→CH4+C3H6, 因此0.2mol丁烷完全裂解,产生乙烯的物质的量不一定是0.2mol,即乙烯分子数不一定是0.2NA, 故A错误;
B.13gNaN3的物质的量![]() , 反应过程中Na由+1价变为0价,因此转移电子数为0.2mol×1×NA=0.2NA,故B正确;
, 反应过程中Na由+1价变为0价,因此转移电子数为0.2mol×1×NA=0.2NA,故B正确;
C.溶液中存在NH4+的水解平衡,因此溶液中NH4+数小于0.2NA,故C错误;
D.容器中存在可逆反应N2O4(g)2NO2(g),因此产生的气体分子数小于0.4NA,故D错误;
故答案为:B。

【题目】某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出C、D、的化学式:C_______,D______。
(2)将含1 mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,请写出A与E反应的离子方程式:_______________。
(3)在A溶液中加入少量澄清石灰水,其离子方程式为_____________________。
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理______________________。
(5)若向含溶质0.5 mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为__________g。