题目内容
取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化:
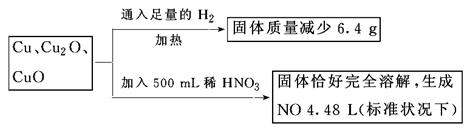
则转化过程中所加稀HNO3的物质的量浓度为

则转化过程中所加稀HNO3的物质的量浓度为
| A.3.2 mol·L- | B.3.6 mol·L-1 | C.4.0 mol·L-1 | D.4.4mol·L-1 |
A
固体混合物提供的氧与氢气结合使固体质量减少6.4 g,因此氧化亚铜和氧化铜的总物质的量为0.4 mol。生成一氧化氮4.48 L(标准状况下),即为0.2 mol,反应过程中转移电子0.6 mol,起氧化作用的硝酸为0.2 mol。设铜的物质的量为x、氧化亚铜的物质的量为y、氧化铜的物质的量为(0.4 mol-y),则参加反应的硝酸的物质的量为(x+y+0.4 mol)×2+0.2 mol。由电子守恒得2x+2y=0.6 mol,解得(x+y+0.4 mol)×2+0.2 mol=1.6 mol,c(HNO3)=1.6mol÷0.5L=3.2 mol/L,答案选A。

练习册系列答案
相关题目