题目内容
【题目】甲醇不仅作为F1赛车的燃料添加剂,也广泛应用于甲醇燃料电池。某燃料电池装置如图所示,下列说法错误的是( )
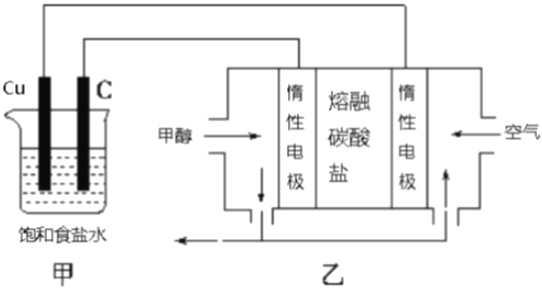
A. 乙池负极反应为:CH3OH-6e-+3CO32-=4CO2↑+2H2O
B. 乙池中电池工作时,CO32-不断移向负极
C. 理论上32g甲醇被消耗时,C极上放出气体体积(标准状况下)为67.2L
D. 甲池中Cu电极发生的反应为2Cl--2e-=Cl2↑
【答案】D
【解析】乙为甲醇燃料电池,电解质是熔融碳酸盐,所以甲醇为负极,空气为正极。总反应为:CH3OH+3/2O2 = CO2 + 2H2O,正极为空气中的氧气得电子,因为电解质是熔融的碳酸盐(没有水,也没有氢离子),所以反应为:O2 + 2CO2 + 4e- = 2CO32-。用总反应减去正极反应(注意将正极反应扩大3/2倍),得到负极反应:CH3OH-6e-+3CO32-=4CO2↑+2H2O,选项A正确。原电池中阴离子向负极移动,所以选项B正确。根据负极反应,消耗1mol甲醇,转移6mol电子,所以在C电极(为电解的阴极,反应为2H+ + 2e- = H2↑)上得到3mol氢气,标准状况下体积为67.2L。选项C正确。甲池中Cu电极为电解的阳极,所以发生的反应为Cu-2e-=Cu2+,选项D错误。

练习册系列答案
相关题目