题目内容
【题目】下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
A.
2 | ||
11 | ||
19 |
B.
2 | 3 | 4 |
11 | ||
19 |
C.
6 | ||
11 | 12 | 13 |
24 |
D.
6 | 7 | |
14 | ||
31 | 32 |
【答案】D
【解析】解:A.原11、19是碱金属元素的原子序数,应位于周期表的最左边,2号元素为零族元素,两族不相邻,位置不合理,故A错误;B.原子序数为2的位于0族,原子序数3、11、19均为第ⅠA族,位置不合理,故B错误;
C.原子序数为6、12、14的不在同一族,位置不合理,故C错误;
D.原子序数为31的位于第ⅢA,原子序数为6、14、32位于第ⅣA族,原子序数为7的位于第ⅤA,位置合理,故D正确;
故选D.

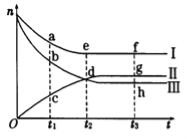
【题目】(6分)在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡(X、Y、Z均为气态)。

(1)该反应的化学方程式是 。
(2)反应起始至t时刻,Y的平均反应速率是 。
(3)关于该反应的说法正确的是 。
A.到达t时刻该反应已停止 |
B.在t时刻之前X的消耗速率大于它的生成速率 |
C.在t时刻正反应速率等于逆反应速率 |
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等 |
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),这种元素的原子结构示意图为___________。
(2)④与⑤两种元素相比较,原子半径较大的是_______(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是______(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是_______(填化学式),具有两性的化合物是_______(填化学式)。
(3)③与⑥元素的氢化物的稳定性_________ 大于 __________(填化学式)。
(4)元素④和元素⑦形成化合物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
(5)⑦的氢化物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
【题目】某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:
仪器:试管、胶头滴管
药品:氯水、溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容):
序号 | 实验方案 | 实验现象 |
① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
② | 向盛有少量碘化钾溶液的试管中滴加少量新制溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
(4)实验结论:____________________。
(5)问题和讨论:
①上述两个实验中发生的反应的离子方程式分别为_________、________。
②由于氟过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强:_______、_____。