题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),这种元素的原子结构示意图为___________。
(2)④与⑤两种元素相比较,原子半径较大的是_______(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是______(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是_______(填化学式),具有两性的化合物是_______(填化学式)。
(3)③与⑥元素的氢化物的稳定性_________ 大于 __________(填化学式)。
(4)元素④和元素⑦形成化合物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
(5)⑦的氢化物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
【答案】 Ar 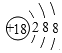 Na HClO4 NaOH Al(OH) 3 H2O H2S
Na HClO4 NaOH Al(OH) 3 H2O H2S ![]() 离子键 离子 略
离子键 离子 略 ![]() 共价键(或极性共价键) 共价 略
共价键(或极性共价键) 共价 略
【解析】根据元素在周期表中的相对位置可知①~⑧种元素分别是C、N、O、Na、Al、S、Cl、Ar。则
(1)在这些元素中,化学性质最不活泼的是稀有气体Ar,这种元素的原子结构示意图为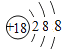 。(2)同周期自左向右原子半径逐渐减小,则④与⑤两种元素相比较,原子半径较大的是Na;同周期自左向右非金属性逐渐增强,最高价含氧酸的酸性逐渐增强,则在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是HClO4。在金属元素氧化物所对应的水化物中,碱性最强的化合物是NaOH,具有两性的化合物是Al(OH) 3。(3)同主族从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则③与⑥元素的氢化物的稳定性:H2O>H2S。(4)元素④和元素⑦形成化合物是含有离子键的离子化合物氯化钠,电子式为
。(2)同周期自左向右原子半径逐渐减小,则④与⑤两种元素相比较,原子半径较大的是Na;同周期自左向右非金属性逐渐增强,最高价含氧酸的酸性逐渐增强,则在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是HClO4。在金属元素氧化物所对应的水化物中,碱性最强的化合物是NaOH,具有两性的化合物是Al(OH) 3。(3)同主族从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则③与⑥元素的氢化物的稳定性:H2O>H2S。(4)元素④和元素⑦形成化合物是含有离子键的离子化合物氯化钠,电子式为![]() 。表示该化合物的形成过程为
。表示该化合物的形成过程为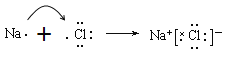 。(5)⑦的氢化物氯化氢是含有共价键的共价化合物,电子式为
。(5)⑦的氢化物氯化氢是含有共价键的共价化合物,电子式为![]() ,表示该化合物的形成过程为
,表示该化合物的形成过程为![]() 。
。