题目内容
【题目】含氮化合物在生活、生产和科技等方面有重要的应用。
⑴已知298 K时,亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,H2CO3的电离平衡常数 Ka1=4.2×10-7、Ka2=5.61×10-11。
① NaNO2溶液呈____(填“酸性”“碱性”或“中性”),原因是_________(用离子方程式表示)。
②向含有1 mol碳酸钠的溶液中加入1 mol HNO2后,溶液中c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为________________。
(2)电化学催化净化NO是处理含氮化合物的一种新方法,原理如图所示,固体电解质起到传导O2-的作用。b极为电源的_____(填“正极”或“负极”),通入NO的电极上的电极反应式为______。

⑶N2O5是绿色硝化剂,能溶于水生成硝酸。常温下,向0.1 mol·L-1的氨水中加入少量N2O5,使溶液中c(NH3H2O):c(NH4+)=5 : 9,此时溶液中 c(NH4+)+c(H+) — c(NO3-)=_____。 (25℃时,NH3H2O的电离常数Kb=1.8×10-5)
【答案】 碱性 NO2-+H2O=HNO2+OH- c(NO2-)>c(HCO3-)>c(CO32-) 正极 2NO+4e-=N2+2O2- 1.0×10-5 mol·L-1
【解析】⑴①根据亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,亚硝酸为弱酸,NaNO2溶液水解显碱性,故答案为:碱性;NO2-+H2O=HNO2+OH-;
②由亚硝酸的电离平衡常数Ki=5.1×10-4,H2CO的Ki1=4.2×10-7,Ki2=5.61×10-11,向含有1 mol碳酸钠的溶液中加入1 mol HNO2后,生成亚硝酸钠和碳酸氢钠,水解程度大小顺序为HCO3->NO2-,碳酸氢钠溶液显碱性,电离程度小于水解程度,所以溶液中CO32-离子、HCO3-离子和NO2-离子的浓度大小关系为c(NO2-)>c(HCO3-)>c(CO32-),故答案为:c(NO2-)>c(HCO3-)>c(CO32-);
(2)反应原理是利用电解吸收NO生成氮气,氮元素化合价+2价变化为0价,发生还原反应,在电解池的阴极发生还原反应,则a为外接电源的负极,b极为外接电源的正极,固体电解质起到传导作用的是O2-,通入NO的电极反应式为2NO+4e-=N2+2O2-,故答案为:正;2NO+4e-=N2+2O2-;
⑶N2O5能溶于水生成硝酸。向0.1 mol·L-1的氨水中加入少量N2O5,氨气与硝酸反应生成硝酸铵,溶液中c(NH3H2O):c(NH4+)=5 : 9,即c(NH4+)=![]() mol/L ,c(NH3H2O)=
mol/L ,c(NH3H2O)= ![]() mol/L ,根据NH3H2O的电离常数Kb=1.8×10-5,有Kb=1.8×10-5=
mol/L ,根据NH3H2O的电离常数Kb=1.8×10-5,有Kb=1.8×10-5=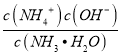 =
=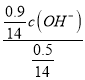 ,解得c(OH-)=1.0×10-5 mol/L,根据电荷守恒c(NH4+)+c(H+) — c(NO3-)= c(OH-)=1.0×10-5 mol/L,故答案为:1.0×10-5 mol/L。
,解得c(OH-)=1.0×10-5 mol/L,根据电荷守恒c(NH4+)+c(H+) — c(NO3-)= c(OH-)=1.0×10-5 mol/L,故答案为:1.0×10-5 mol/L。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
