题目内容
【题目】常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸中,反应过程中溶液pH和所加NaOH溶液的体积关系如下图所示。

(1)由图可知,硫酸的物质的量浓度为_____________;
(2)计算NaOH溶液的物质的量浓度;
(3)计算加入10mLNaOH溶液时,溶液的pH
(已知 lg2=0.3;混合后溶液的体积按混合前两种溶液的体积之和计算)。
【答案】(1)0.05mol/L(2)0.08mol/L(3)1.4(或2-2lg2)
【解析】本题分析:本题主要考查关于中和反应的计算。
(1)由图可知,硫酸的物质的量浓度为![]() ×0.1mol/L=0.05mol/L;
×0.1mol/L=0.05mol/L;
(2)加入NaOH溶液25mL时pH=7,此时NaOH与H2SO4恰好完全反应,NaOH溶液的物质的量浓度为(0.1mol/L×20.00mL)/25mL=0.08mol/L;
(3)c(H+)=( 0.1mol/L×20.00mL-0.08mol/L×10mL)/30mL=0.04mol/L,pH=-lg0.04=1.4(或2-2lg2)。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。
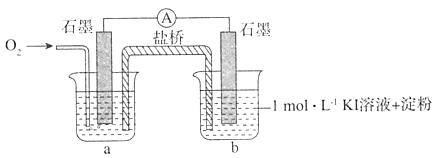
i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。