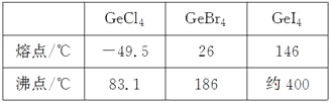
题目内容
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。化合物R是由A、D两元素形成的离子化合物,其中A+阳离子与Dn-阴离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为______________,在CB3分子中C元素原子的原子轨道发生的是______杂化。
(2)C的氢化物的空间构型为________________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________________________________________________________。
(3)B元素的电负性____D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:________________________________。
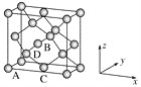
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为_________________。(阿伏加德罗常数用NA表示)

【答案】 ls22s22p63s23p6或者[Ne]3s23p6 sp3 三角锥形 NH3分子之间存在氢键作用 > Cl2+Na2S=2NaCl+S↓ 312/NAa3
【解析】分析:B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B-离子为Cl-离子,A+比B-少一个电子层,A+为Na+离子;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素,A+是Na+离子,D2-离子是S2-离子,R是由Na+离子与S2-离子以2:1形成的离子化合物,R是硫化钠。
解析:
(1)B离子为Cl离子,电子排布式为ls22s22p63s23p6或者[Ne]3s23p6;CB3分子为NCl3分子,N原子有一对孤对电子,与Cl原子成3个δ键,杂化轨道数为1+3=4,所以为sp3杂化。故答案为:ls22s22p63s23p6或者[Ne]3s23p6;sp3。
(2)C的氢化物为NH3,N原子采取sp3杂化,N原子有一对孤对电子,所以NH3为三角锥形,N原子电负性很强,氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高。故答案为:三角锥形;氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高。
(4)B为Cl元素,D为S元素,同周期,自左而右,电负性增强,所以电负性Cl>S.利用“在氧化还原反应中,氧化剂氧化性大于氧化产物”原理,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在Cl2+Na2S=2NaCl+S↓反应中,Cl2的氧化性大于O2的氧化性。故答案为:>;Cl2+Na2S=2NaCl+S↓
(5)A+是Na+离子,D2离子是S2离子,根据均摊法计算,晶胞含有S2离子个数8×1/8+6×1/2=4,含有A+是Na+离子8个,即一个晶胞含有4个硫化钠分子,所以密度为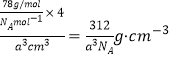 ,故答案为:
,故答案为:![]() 。
。