题目内容
【题目】铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中发生的一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移_______mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移_______mol电子。
(2)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为________________。从腐蚀废液中回收金属铜还需要的试剂是__________。
(3)与明矾相似,硫酸铁也可用于净水,其作用原理是____________________(用离子方程式表示);在使用时发现硫酸铁并不能使酸性废水中悬浮物沉降除去,其原因是_______________。
(4)铁红是一种红色颜料,其主要成分是Fe2O3。将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24 L氢气(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为_____。
【答案】322Fe3++Cu![]() 2Fe2++Cu2+ 铁粉、稀盐酸(其他合理答案均可)Fe3++3H2O
2Fe2++Cu2+ 铁粉、稀盐酸(其他合理答案均可)Fe3++3H2O![]() Fe(OH)3(胶体)+3H+在酸性条件下抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去11.2 g
Fe(OH)3(胶体)+3H+在酸性条件下抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去11.2 g
【解析】
(1)3FeS2+8O2![]() 6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol,
6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol,
故答案为:32;
(2)氯化铁溶液与铜反应生成氯化铜和氯化亚铁,该离子反应为2Fe3++Cu=2Fe2++Cu2+,利用置换反应得到Cu,过量铁粉利用稀硫酸除去,则选试剂为铁粉、稀硫酸,故答案为:2Fe3++Cu=2Fe2++Cu2+;铁粉、稀硫酸(其他合理答案均可);
(3)硫酸铁能用于净水是因为铁离子发生水解生成了氢氧化铁胶体,反应原理为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;而酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体,则硫酸铁并不能使酸性废水中的悬浮物沉降除去,故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+;而酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体,则硫酸铁并不能使酸性废水中的悬浮物沉降除去,故答案为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;在酸性条件下抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去;
Fe(OH)3(胶体)+3H+;在酸性条件下抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去;
(4)盐酸中HCl的物质的量为0.16 L×5 mol·L-1=0.8mol,生成氢气的物质的量为2.24L÷22.4L/mol=0.1mol,设氧化铁的物质的量为xmol,则有:
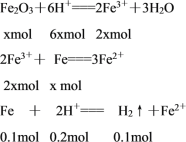
由题意得:0.2 mol+6x=0.16 L×5 mol·L-1,x=0.1 mol;参加反应的铁粉质量为(0.1 mol+x)×56 g·mol-1=11.2 g,故答案为:11.2 g。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | ||||||||||||||||
试回答下列问题:
(1)请写出元素o的基态原子电子排布式________
(2)d的最简单氢化物的分子空间立体构型为_________,中心原子的杂化形式为_________;k在空气中燃烧产物的分子空间立体构型为________,中心原子的杂化形式为______,该分子是_____(填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表______(填元素符号);其中电负性最大的是_______(填下图中的序号)。

(4)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比 熔点更高的是________(填化学式),试从结构角度加以解释:______________________________