题目内容
【题目】一定条件下,A、B、C三种气体在绝热密闭容器中随反应进行,温度升高;且各物质浓度的变化情况如图所示,通过分析回答: 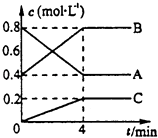
(1)写出对应反应的化学方程式:;
(2)前4分钟A的分解速率是;其转化率是;
(3)4分钟后保持其他条件不变,只改变下列条件,A的体积分数将(填“增大、减小、不变”)
①增大压强:;
②降低温度: .
【答案】
(1)2A?2B+C
(2)0.1 mol/(L?min);50%
(3)增大;减小
【解析】解:(1)由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.4mol/L:0.4mol/L:0.2mol/L=2:2:1,则反应的化学方程式为:2A(g)2B(g)+C(g),
所以答案是:2A(g)2B(g)+C(g);
(2.)前4分钟A的浓度变化=0.8mol/L﹣0.4mol/L=0.4mol/L,分解速率= ![]() =0.1 mol/(Lmin),A的转化率=
=0.1 mol/(Lmin),A的转化率= ![]() ×100%=50%,
×100%=50%,
所以答案是:0.1 mol/(Lmin); 50%;
(3.)①4分钟后保持其他条件不变,增大压强平衡向气体体积减小的方向进行,A的体积分数将增大,所以答案是:增大;
②4分钟后保持其他条件不变,反应为分解反应属于吸热反应,反应降低温度平衡向放热的方向进行,平衡逆向进行,A的体积分数将减小,所以答案是:减小.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目