题目内容
下列实验操作、现象或反应原理的解释、结论均正确的一组是
| 操作、现象 | 解释或结论 |
| A.铝箔在酒精灯火焰上加热,熔化但不滴落 | 铝箔对熔化的铝有吸附作用 |
| B.向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 | 增大反应物的浓度,化学平衡向正反应方向移动 |
| C.向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热,未见红色沉淀 | 淀粉未水解 |
| D.取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
B
解析试题分析:A、解释不正确,将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,又因三氧化二铝的熔点高于铝的熔点,而三氧化二铝在铝的表面,所以加热铝箔的时候铝熔化了但是不会滴落。B、正确,Fe3++3SCN- Fe(SCN)3为可逆反应,增大反应物浓度,平衡向正方向移动。C、不正确,向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热,未见红色沉淀,操作不正确,在加入新制的氢氧化铜悬浊液前必须用NaOH将H2SO4中和至弱碱性。D、不正确,由于加入了HCl,白色沉淀也可能是AgCl。选B。
Fe(SCN)3为可逆反应,增大反应物浓度,平衡向正方向移动。C、不正确,向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热,未见红色沉淀,操作不正确,在加入新制的氢氧化铜悬浊液前必须用NaOH将H2SO4中和至弱碱性。D、不正确,由于加入了HCl,白色沉淀也可能是AgCl。选B。
考点:化学基本实验,物质的性质和物质的检验

练习册系列答案
相关题目
下列因果关系叙述正确的是
| A.SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C.Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
下列有关物质的性质和该性质的应用叙述不正确的是
| A.所有酸中,二氧化硅只与氢氟酸反应,可用石英制造耐酸容器 |
| B.工业上金属Mg、Al都是用电解其熔融的氯化物制得的 |
| C.二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D.若铁制品表面的钢镀层有破损,会加快铁制品腐蚀 |
如图所示装置,将胶头滴管中的液体A滴入烧瓶中,片刻后,打开夹子,右侧试管内的水沸腾,则A和B的组合可能是
| 选项 | 液体A | 液体B |
| A | NaCl溶液 | O2 |
| B | H2O | NH3 |
| C | 盐酸 | CO2 |
| D | NaOH溶液 | CO |
下列物质的转化在给定条件下能实现的是
①Al2O3 NaAlO2(aq )
NaAlO2(aq ) Al(OH)3
Al(OH)3
②S SO3
SO3 H2SO4
H2SO4
③Fe2O3 FeCl3 (aq)
FeCl3 (aq) 无水FeCl3
无水FeCl3
④饱和NaCl(aq) NaHCO3
NaHCO3 Na2CO3
Na2CO3
⑤MgCl2 (aq) Mg(OH)2
Mg(OH)2 MgO
MgO
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
下列由相关实验现象所推出的结论正确的是
| A.二氧化硫能漂白某些物质,说明它具有氧化性 |
| B.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
| C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
下列实验中,依据实验操作及现象,得出的结论正确的是( )
| | 操作 | 现象 | 结论 |
| A. | 用食醋浸泡水垢。[水垢成分: CaCO 3与Mg(OH)2] | 水垢溶解,有无色气泡 | 碱性:CH3COONa>Na2CO3 |
| B. | 浓硫酸与氯化钠固体微热 | 产生刺激性气味气体 | 酸性:H2SO4>HCl |
| C. | 向FeCl2溶液中通入过量Cl2 | 溶液由浅绿色变成黄色 | 还原性: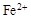 > >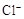 |
| D. | 向盛有1mL 0.1mol/LNaCl 溶液的试管中滴加2~4滴 0.1mol/LAgNO3溶液,后继续 滴加1mL 0.1mol/LKI溶液。 | 先出现白色沉淀,后变 成黄色沉淀 | 溶解度:AgI>AgCl |