题目内容
【题目】汽车尾气脱硝脱碳主要原理为: ![]()
![]()
![]() 。一定条件下密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
。一定条件下密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
|
|
|
|
|
|
|
|
|
|
|
|
完成下列填空:
(1)写出该反应的平衡常数表达式:__________________。
(2)前2s内的氮气的平均反应速率是: ![]() =___________
=___________ ![]() ;
;
达到平衡时,CO的转化率为_______________。
(3)工业上常采用“低温臭氧氧化脱硫脱硝”技术来同时吸收![]() 和氮的氧化物气体(
和氮的氧化物气体(![]() ),以获得
),以获得![]() 的稀溶液。在此溶液中,水的电离程度是受到了_________(填“促进”、“抑制”或“没有影响”);若往
的稀溶液。在此溶液中,水的电离程度是受到了_________(填“促进”、“抑制”或“没有影响”);若往![]() 溶液中再加入少量稀盐酸,则
溶液中再加入少量稀盐酸,则![]() 值将__________(填“变大”、“变小”或“不变”)。
值将__________(填“变大”、“变小”或“不变”)。
(4)如果向![]() 溶液中通入足量
溶液中通入足量![]() 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象。_________________________。
气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象。_________________________。
(5)向另一种可溶性钡盐溶液中通入少量![]() 气体,会立即看到白色沉淀,该沉淀的化学式为_________;原可溶性钡盐可能是_________________。
气体,会立即看到白色沉淀,该沉淀的化学式为_________;原可溶性钡盐可能是_________________。
【答案】 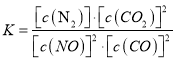 变小 1.75×10-3 0.89 促进 变大 饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生 BaSO4、Ba(NO3)2
变小 1.75×10-3 0.89 促进 变大 饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生 BaSO4、Ba(NO3)2
【解析】(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,所以K=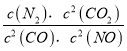 ,故答案为:K=
,故答案为:K=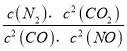 ;
;
(2)v(NO)= ![]() =3.5×10-3mol/(Ls),再根据反应速率与计量数关系得υ(N2)=1.75×10-3mol/(Ls);CO转化率=
=3.5×10-3mol/(Ls),再根据反应速率与计量数关系得υ(N2)=1.75×10-3mol/(Ls);CO转化率=![]() ×100%=
×100%=![]() ×100%=89%,故答案为:1.75×10-3;89%;
×100%=89%,故答案为:1.75×10-3;89%;
(3)(NH4)2SO4溶液存在铵根的水解平衡,促进水的电离;在(NH4)2SO4溶液中存在水解反应,2NH4++H2ONH3H2O+H+,往(NH4)2SO4溶液中加入少量稀盐酸,水解平衡向逆方向进行,的水解率减小,物质的量增大,而硫酸根离子的物质的量不变,所以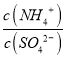 将变大,故答案为:促进;变大;
将变大,故答案为:促进;变大;
(4)因为饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀,加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生,故答案为:饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀,而加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生;
(5)向硝酸钡溶液中通入少量![]() 气体,溶液显酸性,二氧化硫被硝酸氧化生成硫酸,会立即看到白色沉淀硫酸钡,故答案为:BaSO4;Ba(NO3)2。
气体,溶液显酸性,二氧化硫被硝酸氧化生成硫酸,会立即看到白色沉淀硫酸钡,故答案为:BaSO4;Ba(NO3)2。

 名校课堂系列答案
名校课堂系列答案